Опыт 4. Влияние катализатора на скорость реакции
Разложение перекиси водорода при комнатной температуре идет медленно, реакцию можно ускорить путем введения катализатора оксида марганца (IV) MnO2
2H2O2 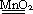 2H2O+O2
2H2O+O2 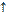
Внесите в пробирку 20 капель перекиси водорода. Поднесите к отверстию пробирки тлеющую лучину.
Затем добавьте в пробирку с помощью шпателя несколько кристаллов катализатора оксида марганца (IV). Поднесите к отверстию пробирки тлеющую лучину.
Проверьте, произошли ли какие-нибудь изменения с катализатором в результате химической реакции. Опишите наблюдаемые явления.
Обработка результатов:
1. Запишите кинетическое уравнение реакции.
2. Почему порядок данной реакции не совпадает с молекулярностью?
3. Объясните, почему происходит ускорение химической реакции в присутствии катализатора.
Опыт 5. Влияние концентрации реагирующих веществ на состояние равновесия.
В стакан налейте 10 мл 2%-ного раствора хлорида железа (III) FeCl3 и добавлено 10 мл 1%-ного раствора радонида калия KCNS. Полученный раствор разделите на 4 пробирки. В первую добавьте 3 − 5 капель концентрированного раствора FeCl3, во вторую – 2 − 3 капли концентрированного раствора KCNS, в третью − поместите немного твердого хлорида калия KCl. Четвертая пробирка является контрольной. Cравните интенсивность окраски полученных растворов. Данные записываются в таблицу.
Таблица 2.3 – Отчетная таблица
| № опыта | Добавленное вещество | Изменение интенсивности окраски (усиление, ослабление) | Направление смещения равновесия |
| FeCl3 | |||
| KCNS | |||
| KCl | |||
| Контрольная |
Уравнение реакции:
FeCl3+3KCNS ↔ Fe(CNS)3+3KCl
Обработка результатов:
1. Запишите выражение константы равновесия для данной реакции.
2. Объясните почему происходит усиление или ослабление интенсивности окраски растворов.
Опыт 6. Влияние температуры на состояние равновесия
В пробирку налейте 4 − 5 мл раствора крахмала. К нему прилейте несколько капель раствора йода до появления синего окрашивания. Сначала пробирку нагрейте в сосуде с горячей водой, а затем охладите до комнатной температуры.
Уравнение реакции (схема):
йод + крахмал ↔ йодокрахмал (Н<0).
Опишите наблюдаемые явления.
Объясните почему меняется интенсивность окрашивания раствора при изменении температуры.
Сформулируйте принцип Ле Шателье.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что называют скоростью химических реакций?
2. От чего зависит константа скорости химических реакций?
3. Сформулируйте закон действующих масс.
4. Что представляет собой энергия активации?
5. Какие существуют механизмы химических реакций?
6. Методы активирования химических реакций.
7. От чего зависит скорость гетерогенных реакций?
8. Необратимые и обратимые реакции.
9. Какие вещества называют катализаторами и ингибиторами?
10. От чего зависит константа равновесия?
11. Сформулируйте принцип Ле Шателье.
12. Методика проведения лабораторной работы.
13. Объясните физический смысл константы скорости.
14. Сформулируйте правило Вант-Гоффа.
15. От чего зависит энергия активации?
16. Какие вещества называют промоторами и каталитическими ядами?
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача 1.Во сколько раз изменится скорость прямой реакции N2(г)+3Н2(г)↔ 2NH3(г), если давление в системе увеличить в 2 раза?
Решение
Увеличение давления в системе в 2 раза равносильно уменьшению объема системы в 2 раза. При этом концентрации реагирующих веществ возрастут в 2 раза. Согласно закону действующих масс, начальная скорость реакции равна υн = k∙[N2]∙[H2]3. После увеличения давления в 2 раза концентрации азота и водорода увеличатся в 2 раза, и скорость реакции станет равна υк = k∙2[N2]∙23[H2]3 = k∙16[N2]∙[H2]3. Отношение υк./υн показывает, как изменится скорость реакции после изменения давления. Следовательно, υк/υн = k∙16[N2]∙[H2]3/k∙[N2]∙[H2]3=16.
Ответ: скорость реакции увеличится в 16 раз.
Задача 2. Во сколько раз изменится скорость прямой и обратной реакции в системе: 2SO2(г) + O2(г) ↔2SO3(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение
Обозначим концентрации реагирующих веществ: [SO2] = а, [O2] = b, [SO3] = c. Согласно закону действия масс, скорости и прямой и обратной реакций до изменения объема
υпр = k·а2·b ; υобр = k1·с2
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3a, [O2] = 3b, [SO3] = 3c. При новых концентрациях скорости υ' прямой и обратной реакций: υ'пр = k·(3a)2·(3b) = 27·k·a2·b; υ'обр= k1·(3с)2 = 9·k1·с2. Отсюда
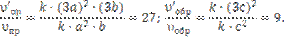
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Задача 3. В реакции С(т)+2H2(г) ↔ CH4(г) концентрацию водорода уменьшили в 3 раза. Как изменится скорость реакции?
Решение
Согласно закону действующих масс, начальная скорость реакции равна υн=k∙[H2]2. После уменьшения концентрации водорода в 3 раза скорость станет равна υк=k∙(1/3)2[H2]2 =1/9k[H2]2. После изменения концентрации водорода скорость изменится следующим образом: υк/υн=1/9k[H2]2/k[H2]2=1/9.
Ответ: скорость реакции уменьшится в 9 раз.
Задача 4. Во сколько раз возрастет скорость реакции при повышении температуры с 10 до 30 oС (γ = 3)?
Решение
При увеличении температуры с 10 до 30 oС скорость реакции в соответствии с правилом Вант-Гоффа возрастает:
υ2/υ1=γ(t2-t1)/10, где t2=30 oC, t1=10 oC, а υ2 и υ1 – скорости реакции при данных температурах. Получаем υ2/υ1=3(30–10)/10=32=9, т.е. скорость реакции увеличится в 9 раз.
Ответ: 9.
Задача 5. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 0С, если температурный коэффициент реакции равен 2.
Решение
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
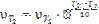 ;
;
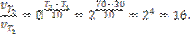
Следовательно, скорость реакции при температуре 70 0С больше скорости реакции при температуре 30 0С в 16 раз.
Задача 6. Равновесие реакции 2H2(г)+O2(г) ↔ 2H2O(г) ; ∆H<0 смещается вправо:
1) при уменьшении давления; 2) при увеличении давления?
Решение
Все вещества в системе – газы. В соответствии с принципом Ле Шателье, повышение давления приводит к смещению равновесия в сторону реакции, приводящей к меньшему количеству молей газов, т.е. в сторону образования Н2О. Следовательно, повышение давления в системе смещает равновесие реакции вправо.
Ответ: при увеличении давления.
Задача 7. В какую сторону сместится равновесие реакции 2SO2(г)+O2(г)↔ 2SO3(г); ∆H<0 при повышении температуры?
Решение.
Поскольку ∆H<0, теплота выделяется в ходе прямой реакции, которая является экзотермической. Обратная реакция будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, т.е. равновесие сместится в сторону исходных веществ.
Ответ: влево.
Задача 8. Определите константу равновесия реакции NOCl2(г)+NO(г) ↔ 2NOCl(г), если при некоторой температуре равновесные концентрации веществ составляют [NOCl2]=0,05; [NO]=0,55; [NOCl]=0,08 моль/л.
Решение
Константа равновесия обратимой химической реакции равна отношению произведения равновесных концентраций продуктов к произведению равновесных концентраций исходных веществ. Значение каждой из концентраций должно быть возведено в степень, равную стехиометрическому коэффициенту перед соответствующим веществом в уравнении реакции. Поэтому
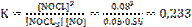 .
.
Ответ: 0,233.
Задача 9. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению:
РСl5(г)↔ РСl3(г)+Сl2(г); ∆Н = + 92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения РСl5?
Решение
Смещением, или сдвигом химического равновесия, называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения PCl5 эндотермическая (∆Н > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение PCl5 ведет к увеличению объема газообразных веществ (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещение равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации PCl3 или Cl2.
Задача 10. Один моль аммиака поместили в сосуд объемом 20 л и нагрели до 600 0C. Давление в сосуде оказалось равным 435 кПа. Рассчитайте степень разложения аммиака.
Решение
Количество (моль) газов после реакции:
PV/RT = 435∙20/(8,31∙873) = 1,20 моль
Если разложилось х моль аммиака, то схема разложения:
Осталось NH3 (1-х); получилось N2 (х/2) + H2 (3х/2)
Из уравнения: 1,20 моль = (1-x) + x/2 + 3x/2 = 1+x
получим x = 0,2 моль.
Ответ: Степень разложения аммиака 20 %.
Задача 11. Смешали по три моля веществ А, В, С. После установления равновесия А + В = 2С в системе обнаружили 5 моль вещества С. Рассчитайте константу равновесия. Определите равновесный состав смеси (в мольных %), полученной смешением веществ А, В, С в мольном соотношении 3:2:1 при той же температуре.
Решение
Первый случай:
| A + | B = | 2C. |
Соотношение количества веществ (моль) соответствует соотношению их коэффициентов в уравнении. Если С стало на 2 моль больше (5 из 3), то количество А и В уменьшились на 1 моль каждое. В результате при установлении равновесия стало 5 моль С, по 2 моль А и В.
Константа равновесия:
К = [С] 2 / ([А][В]) = 25/2∙2 = 6,25
Второй случай:
Мольное соотношение то же, примем за х число молей прореагировавших А и В (они одинаковы):
| x | x 2 x | |
| A + | B = 2C |
К = (1+2х) 2 /{(3-х)(2-х)} = 6,25.
х = 1,115.
Ответ:Мольные доли веществ в равновесной смеси:
(А) = (3-1,115)/6 = 0,314 ;
(В) = (2-1,115)/6 = 0,148 ;
(С)= 0,538.
Задача 12. Константа равновесия реакции N2 + 3H2 ↔ 2NH3 равна 0,1 (при 400 oС). Равновесные концентрации [Н2] = 0,2 моль/л и [NН3] = 0,08 моль/л. Вычислить начальную и равновесную концентрации азота.РешениеЗаписываем выражение для константы равновесия К:K = ([NH3]2/ ([N2]∙[H2]3)Подставляем в выражение для К данные задачи:0,1 = (0,082/ ([N2]∙0,23)Отсюда рассчитываем равновесную концентрацию [N2] = 8 моль / лДалее находим начальную концентрацию азота, учитывая, что из одного моль азота согласно уравнению реакции образуется 2 моль аммиака, т.е. для получения 0,08 моль аммиака требуется 0,04 моль азота. Таким образом, начальная концентрация азота [N2] = 8 + 0,04 =8,04 моль/л.Ответ: Равновесная концентрация азота 8 моль/л, начальная – 8,04 моль/л.Задача 13.Некоторая реакция при 0 oС протекает практически до конца за 4,5 часа (∼16384 с = 214 с). При какой температуре реакция пройдет практически до конца в 1 с (температурный коэффициент скорости равен 2).РешениеПодставляем данные задачи в формулу (1.5):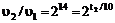 ,находим t2/10 = 14. Отсюда: t2 = 140 oС.Ответ: t2 = 140 oС. Задача 14. Во сколько раз увеличится скорость реакции, протекающей при 300 К, если энергию активации уменьшить на 7 кДж/моль. РешениеВоспользуемся уравнением (1.6). Запишем его для двух скоростей реакций при двух разных энергиях активации, отличающихся на 7 кДж, и поделим одно на другое:
,находим t2/10 = 14. Отсюда: t2 = 140 oС.Ответ: t2 = 140 oС. Задача 14. Во сколько раз увеличится скорость реакции, протекающей при 300 К, если энергию активации уменьшить на 7 кДж/моль. РешениеВоспользуемся уравнением (1.6). Запишем его для двух скоростей реакций при двух разных энергиях активации, отличающихся на 7 кДж, и поделим одно на другое: 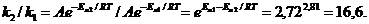
Ответ: В 16,6 раза.
Задача 15.При 37 oС реакция заканчивается за 150 с, а при 47 oC – за 75 с. Вычислить энергию активации.РешениеНайдем энергию активации по формуле (1.7).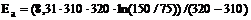 = 57,1 кДж / моль.
= 57,1 кДж / моль. Ответ: 57,1 кДж / моль.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Окисление серы и ее диоксида протекает по уравнениям:
а) S(к) + O2 = SO2(г);
б) 2SO2(г) + О2 = 2SO3(г).
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
2. Напишите выражение для константы равновесия гомогенной системы: N2+3H2↔2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в три раза?
3. Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были: 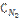 = 0,049 моль/л;
= 0,049 моль/л; 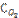 =0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO] = 0,005 моль/л.
=0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO] = 0,005 моль/л.
Ответ: [N2] = 0,0465 моль/л; [O2]= 0,0075 моль/л.
4. Реакция идет по уравнению N2+3H2=2NH3. Концентрации участвующих в ней веществ были: 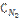 = 0,80 моль/л;
= 0,80 моль/л; 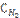 = 1,5 моль/л;
= 1,5 моль/л; 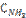 = 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л.
= 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л.
Ответ: [NH3] = 0,70 моль/л; [H2] = 0,60 моль/л.
5. Реакция идет по уравнению H2 + I2 = 2HI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: 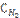 =0,04 моль/л;
=0,04 моль/л; 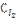 =0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [H2] = 0,03 моль/л.
=0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [H2] = 0,03 моль/л.
Ответ: 3,2 · 10-4; 1,92 · 10-4.
6. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 оС. Температурный коэффициент скорости реакции 3.
7. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 оС, если температурный коэффициент скорости данной реакции 2?
8. Во сколько раз изменится скорость реакции, протекающей в газовой фазе, при понижении температуры на 300 oС, если температурный коэффициент скорости данной реакции 2?
9. В гомогенной системе СО + Cl2 ↔ COCl2 равновесные концентрации реагирующих веществ: [CO] = 0,2 моль/л; [Cl2] = 0,3 моль/л; [COCl2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и СО.
Ответ: К = 20; 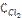 = 1,5 моль/л;
= 1,5 моль/л; 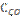 = 1,4 моль/л.
= 1,4 моль/л.
10. В гомогенной системе А + 2В С равновесные концентрации реагирующих газов: [A] = 0,06 моль/л; [B] = 0,12 моль/л; [C] = 0,216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ А и В.
Ответ: К = 250; 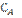 = 0,276 моль/л;
= 0,276 моль/л; 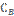 = 0,552 моль/л.
= 0,552 моль/л.
11. В гомогенной газовой системе А + B↔C + D равновесие установилось при концентрациях: [B] = 0,05 моль/л и [C] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В.
Ответ: 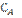 = 0,22 моль/л;
= 0,22 моль/л; 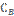 =0,07 моль/л.
=0,07 моль/л.
12. Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + O2, равна 5 · 10-4. Начальная концентрация N2O = 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50% N2O.
Ответ: 1,8 ·10-2; 4,5 · 10-3.
13. Напишите выражение для константы равновесия гетерогенной системы СО2 + С ↔ 2СО. Как изменится скорость прямой реакции – образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
14. Напишите выражение для константы равновесия гетерогенной системы С + Н2О(г) ↔ СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров?
15. Равновесие гомогенной системы: 4НСl(г) + О2 ↔ 2Н2О(г) + 2Cl2(г) установилось при следующих концентрациях реагирующих веществ: [H2O] = 0,14 моль/л; [Cl2] = 0,14 моль/л; [HCl] = 0,20 моль/л; [O2] = 0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода.
Ответ: [HCl]исх = 0,48 моль/л; [O2]исх = 0,39 моль/л.
16. Вычислите константу равновесия для гомогенной системы: CO(г) + H2O(г) ↔ CO2(г)+H2(г), если равновесные концентрации реагирующих веществ: [CO] = 0,004 моль/л; [H2O] = 0,064 моль/л; [CO2] = =0,016 моль/л; [H2] = 0,016 моль/л. Чему равны исходные концентрации воды и СО? Ответ: К = 1; = 0,08 моль/л; =0,02 моль/л.
17. Константа равновесия гомогенной системы СО(г) + Н2О(г) ↔ СО2 + Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: СCO= 0,10 моль/л; 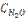 = 0,40 моль/л.
= 0,40 моль/л.
Ответ: [CO2] = [H2] = 0,08 моль/л; [CO] = 0,02 моль/л.; [H2O] = =0,32 моль/л.
18. Константа равновесия гомогенной системы N2 + 3H2↔2NH3 при некоторой температуре равна 1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота.
Ответ: [N2] = 8 моль/л; 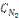 = 8,04 моль/л.
= 8,04 моль/л.
19. При некоторой температуре равновесие гомогенной системы: 2NO + O2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ: [NO] = 0,2 моль/л; [O2] = 0,1 моль/л; [NO2] = 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NO и О2.
Ответ: К = 2,5; 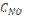 = 0,3 моль/л;
= 0,3 моль/л; 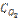 = 0,15 моль/л.
= 0,15 моль/л.
20. Почему при изменении давления смещается равновесие системы: N2 + 3H2 ↔ 2NH3 и не смещается равновесие системы N2 + O2 ↔2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции в этих системах до, и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
21. Исходные концентрации в гомогенной системе:
2NO + Cl2 ↔ 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20 % NO.
Ответ: 0,416.
22. Во сколько раз изменится скорость реакции 2А + В↔А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в два раза?
Ответ: возрастает в 2 раза.
23. Через некоторое время после начала реакции 3A + B↔2C + D концентрации веществ составляли: [А] = 0,03 моль/л; [В] = 0,01 моль/л; [С] = 0,008 моль/л. Каковы исходные концентрации веществ А и В?
Ответ: СА = 0,042 моль/л; СВ = 0,014 моль/л.
24. В системе СО + Cl2↔СОCl2 концентрацию СО увеличили от 0,03 до 0,12 моль/л, а концентрацию хлора – от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
Ответ: в 12 раз.
25. Как изменится скорость реакции 2NO(г) + О2(г) ↔2NO2(г), если:
а) увеличить давление в системе в 3 раза;
б) уменьшить объём системы в 3 раза;
в) повысить концентрацию NO в 3 раза?
Ответ мотивируйте на основании расчета скорости прямой реакции до и после изменения условий.
26. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
Ответ: 2,5.
27. Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
Ответ: в 8 раз.
28. Равновесие в системе Н2(г) + I2(г) ↔ 2 НI(г) установилось при следующих концентрациях: [H2] = 0,025 моль/л; [I2] = 0,005 моль/л; [HI] = 0,09 моль/л. Определить исходные концентрации йода и водорода.
Ответ: 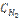 = 0,07 моль/л;
= 0,07 моль/л; 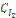 = 0,05 моль/л.
= 0,05 моль/л.
29. В каком направлении сместятся равновесия:
2СО(г) + О2(г) ↔ 2СО2(г); ∆fН = - 566 кДж;
N2(г) + О2(г) ↔ 2NО(г); ∆fН = 180 кДж
а) при понижении температуры; б) при повышении давления?
30. Как повлияет на равновесие следующих реакций:
2Н2(г) + О2(г)↔2Н2О(г); ∆fН = – 483,6 кДж;
СаСО3(к) ↔ СаО(к) + СО2(г); ∆fН =179 кДж
а) повышение давления; б) повышение температуры?
31. Указать, какими изменениями концентраций реагирующих веществ и давления можно сместить вправо равновесие реакции
СО2(г) + С(графит) ↔2СО(г).
32. В загрязненном воздухе содержится примесь CO, которая образуется при неполном сгорании твердого топлива и при работе двигателей внутреннего сгорания. Монооксид углерода медленно окисляется кислородом воздуха до диоксида углерода. При определенных условиях скорость такой реакции составляет 0,05 моль / (л . с), а концентрация CO2 становится равной 0,2 моль/л. Рассчитайте концентрацию CO2 через 10 с после указанного момента.
Ответ: 0,7 моль/л.
33. Один из важных видов сырья для органического синтеза – «водяной газ», смесь водорода и монооксида углерода, которая получается при пропускании водяного пара через башни, наполненные раскаленным углем. Водяной газ служит для получения метанола, формальдегида и других химических продуктов. Рассчитайте значение константы скорости реакции получения водяного газа, если при концентрации H2O, равной 0,03 моль/л, скорость реакции составляет 6,1 . 10--5 моль / (л . с).
Ответ: 2,0 . 10-3 с-1.
34. Атмосферные загрязнения постепенно уничтожают защитный озоновый слой Земли. В реакциях разложения озона участвуют многие газы, но прежде всего оксиды азота. Взаимодействие монооксида азота с озоном приводит к образованию дикислорода и диоксида азота. Рассчитайте скорость этой реакции, если через 25 с после начала реакции молярная концентрация озона была 0,8 моль/л, а через 55 с (от начала реакции) стала равна 0,02 моль/л.
Ответ: 0,026 моль/(л . с).
35. На больших высотах солнечное излучение вызывает диссоциацию молекул кислорода на атомы. Столкновение атомов кислорода и молекул дикислорода приводит к образованию озона, слой которого защищает Землю от коротковолнового излучения Солнца, смертельно опасного для живых организмов. Определите скорость этой реакции, если через 1 мин после ее начала концентрация озона была равна 0,024 моль/л, а через 2 мин после этого момента − 0,064 моль/л.
Ответ: 6,7 . 10-4 моль/(л . с).
36. Причиной образования опасного для здоровья тумана – «смога» − считают большое количество выхлопных газов автомобилей при высокой влажности воздуха. Помимо озона, в смоге присутствует ядовитый диоксид азота, который получается по реакции монооксида азота с атомарным кислородом. Рассчитайте скорость этой реакции, если через 5 минут после ее начала концентрация диоксида азота стала равна 0,05 моль / л, а через 20 минут − 0,08 моль / л.
Ответ: 3,3 . 10-5 моль/(л . с).
37. В гетерогенных химических системах при постоянных термодинамических параметрах установилось состояние равновесия:
а) TiO2(т) + 2 C(т) + 2 Cl2(г) ↔ TiCl4(г) + 2 CO(г)
б) Mg3N2(т) + 6 H2O(г) ↔ 3 Mg(OH)2(т) + 2 NH3(г)
в) Si(т) + 2 H2O(г) ↔ SiO2(т) + 2 H2(г)
г) CS2(г) + 2 Cl2(г) ↔ CCl4(г) + 2 S(т)
д) 2 NO2(г) + 2 S(т) ↔ N2(г) + 2 SO2(г)
e) 10 NO(г) + P4(г) ↔ 5 N2(г) + P4O10(г)
На основании закона действующих масс составьте выражение для константы равновесия.
38.На основании принципа Ле-Шателье определите, в каком направлении сместится равновесие в следующих системах при повышении температуры:
a) 2 NO(г) + O2(г) ↔ 2 NO2(г); ∆Н° < 0;
б) 2 SO3(г) ↔ 2 SO2(г) + O2(г); ∆Н° > 0;
в) C(т) + CO2(г) ↔ 2 CO(г); ∆Н° > 0;
г) 2 NH3(г) ↔ N2(г) + 3 H2(г); ∆Н° > 0;
д) C(т) + 2 Cl2(г) ↔ CCl4(г); ∆Н° < 0;
е) C(т) + 2 N2O(г) ↔ CO2(г) + 2 N2(г); ∆Н° < 0.
39. На основании принципа Ле-Шателье определите, в каком направлении сместится равновесие в следующих системах при повышении давления (Т = const):
a) 2 Fe(т) + 3 H2O(г) ↔ Fe2O3(т) + 3 H2(г)
б) C3H8(г) + 5 O2(г) ↔ 3 CO2(г) + 4 H2O(г)
в) CO2(г) + 2 N2(г) ↔ C(т) + 2 N2O(г)
г) CO(г) + Cl2(г) ↔ CCl2O(г)
д) CH4(г) + 4 S(т) ↔ CS2(г) + 2 Н2S(г)
е) N2H4(г) + O2(г) ↔ N2(г) + 2 H2O(г)
40. На основании принципа Ле-Шателье определите, увеличится ли выход продуктов при одновременном понижении температуры и давления в системах:
a) С(т) + O2(г) ↔ СO2(г); ∆Н° < 0;
б) Н2(г) + I2(т) ↔ 2 HI(г); ∆Н° > 0;
в) 6 HF(г) + N2(г) ↔ 2 NF3(г) + 3 H2(г); ∆Н° > 0;
г) 2 O3(г) ↔ 3 O2(г); ∆Н° < 0;
д) 2 CO(г) ↔ 2 C(т) + O2(г); ∆Н° > 0;
е) I2(т) + 5 CO2(г) ↔ I2O5(т) + 5 CO(г); ∆Н° > 0.
41. На основании принципа Ле-Шателье определите, увеличится ли выход продуктов при повышении температуры и понижении давления одновременно:
a) С(т) + H2O(г) ↔ СO(г) + H2(г); ∆Н° > 0;
б) 2 NO(Cl)(г) + Br2(г) ↔ 2 NO(Br)(г) + Cl2(г); ∆Н° > 0;
в) CO(г) + 2 H2(г) ↔ CH3OH(г); ∆Н° < 0;
г) N2O4(г) ↔ 2 NO2(г); ∆Н° > 0;
д) 8 H2S(г) + 8 I2(т) ↔ S8(т) + 16 HI(г); ∆Н° > 0;
е) 2 CO(г) + O2(г) ↔ 2 CO2(г); ∆Н° < 0.
Согласно заданному варианту выберете номера задач по таблице 2.10 и решите их.
Таблица 5.1 – Варианты задач для самостоятельного решения
| Вариант | 1 (19) | 2 (20) | 3 (21) | 4 (22) | 5 (23) | 6 (24) | 7 (25) | 8 (26) | 9 (27) |
| Номер задач | 1, 19, 37а, 40а | 2, 20, 37б, 40б | 3, 21, 37в, 40в | 4, 22, 37г, 40г | 5, 23, 37д, 40д | 6, 24, 37е, 40е | 7, 25, 38а, 41а | 8, 26, 38б, 41б | 9, 27, 38в, 41в |
| Вариант | 10 (28) | 11 (29) | 12 (30) | 13 (31) | 14 (32) | 15 (33) | 16 (34) | 17 (35) | 18 (36) |
| Номер задач | 10, 28, 38г, 41г | 11, 29, 38д, 41д | 12, 30, 38е, 41е | 13, 31, 39а, | 14, 32, 39б, | 15, 33, 39в, | 16, 34, 39г, | 17, 35, 39д, | 18, 36, 39е, |
ТЕСТЫ
1. Чтобы сместить вправо равновесие химической реакции:
N2(г) + 3 H 2(г) ↔2 NH 3(г) , ∆H < 0
Необходимо:
а) увеличить давление;
б) уменьшить давление;
в) повысить температуру;
г) понизить температуру;
д) увеличить концентрацию аммиака;
е) уменьшить концентрацию аммиака
2. Введение катализатора в систему, находящуюся в состоянии равновесия
а) смещает равновесие в сторону продуктов реакции;
б) смещает равновесие в сторону исходных веществ;
в) не влияет на состояние равновесия;
г) смещает равновесие в сторону экзотермической реакции;
д) смещает равновесие в сторону эндотермической реакции.
3. Для смещения влево равновесия в системе
CO2(г) + С(графит)↔2СO(г); ∆H>0
следует:
а) повысить температуру;
б) понизить температуру;
в) повысить давление;
г) понизить давление;
д) ввести катализатор.
4. k1 и k2 − соответственно константы скоростей прямой и обратной реакций. Скорость обратной химической реакции 2NO2 ↔ 2NO + O2 равна:
а) [NO2]2;
б) k2∙[NO]∙[O2]2;
в) k1∙[NO2]2;
г) k2∙([NO]2 + [O2]);
д) k2∙[NO]2∙[O2];
е) k2∙[NO]∙[O2].
5. Найдите порядок химической реакции
СН3СООСН3 + Н2О(избыток) = СН3СООН + СН3ОН.
Введите ответ числом.
6. Реакция 2SO2(г) + O2(г) = 2 SO3(г) протекает в присутствии V2O5 . Эта реакция является примером:
а) гетерогенного катализа;
б) гомогенного катализа;
в) некаталитической реакции;
г) кислотно-основного катализа;
д) цепной реакции;
е) ферментативного катализа;
ж) автокатализа.
7. Константа равновесия реакции CO(г) + H2(г) ↔ H2O(г) + C(т) равна:
а)Кр = [H2O]/[CO][H2];
б) Кр = [CO] / [C];
в) Кр = 1/[H2O];
г) Кр = [CO]/ [H2O];
д) Кр = [CO].
8. Установите соответствие
| Воздействующий фактор | Смещение равновесия |
| 1) повышение давления; | а) в сторону меньшего объема системы; |
| 2) повышение температуры; | б) в сторону эндотермического процесса; |
| 3) повышение концентрации. | в) в сторону конечных продуктов реакции исходных веществ. |
9. Если образец карбоната магния растворяется в серной кислоте при 25 оС за 16 секунд, а при 55 оС за 2 секунды, то температурный коэффициент скорости реакции равен:
а) 2,67;
б) 0,5;
в) 8;
г) 2.
10. Образование коллоидного раствора происходит путем
а) конденсирования частиц;
б) седиментации частиц;
в)диспергирования частиц;
г) коагуляция частиц.
11. Адсорбционный слой противоионов в формуле мицеллы йодида серебра записывается в виде:
а) x K+;
б) n I-;
в) m [ AgI ];
г) (n - х) К+.
12. Явление переноса частиц дисперсной фазы в постоянном электрическом поле называется
а) электроосмос;
б) электрофорез;
в) потенциал течения;
г) электролиз.
ТЕХНИКА БЕЗОПАСНОСТИ
При работе в лаборатории студент должен иметь халат. Рабочее место не должно быть захламлено ненужной посудой и приборами. Перед началом работы необходимо проверить наличие реактивов, тщательно ознакомиться со свойствами веществ, используемых в работе, чтобы принять все меры предосторожности в случае их вредного действия или огнеопасности.
При термическом ожоге различают три степени. Первая степень характеризуется краснотой. Обожженное место протирают ваткой, смоченной этиловым спиртом. При второй степени ожога появляются пузыри. Обожженное место смачивают спиртом, 3%-ным раствором KMnO4 или 5%-ным раствором танина. При третьей степени ожога разрушается кожная ткань. Накрывают ранку стерильной повязкой и вызывают врача.
При ожоге кислотой промывают обожженное место большим количеством воды (не менее пяти минут под краном), затем 2%-ным раствором питьевой соды или слабым раствором аммиака.
При отравлении ядовитым газом пострадавшего следует вынести на свежий воздух, в случае с сернистым газом промывают нос и полость рта 2%-ным раствором двууглекислого натрия и предоставляют покой.
ЛИТЕРАТУРА
1. Коровин, Н.В. Общая химия /Н.В. Коровин. - М. : Высш. шк., 2000. – 203 с.
2. Глинка, Н.Л. Задачи и упражнения по общей химии: учебное пособие для вузов /Н.Л. Глинка, Х.М. Рубина, под ред. В.А. Рабиновича. − Л. : Химия, 1985. – 103с.
3. Васильева, З.Г. Лабораторный практикум по общей химии /З.Г. Васильева, А.А. Грановская, Е.П. Макарычева, А.А. Таперова, Е.Э. Фриденберг. − М. : Химия, 1969. − 304 с.
4. Глинка, Н.Л. Общая химия /Н.Л. Глинка. – Л. : Химия, 1985. – 704 с.
5. Некрасов, Б.В. Учебник по общей химии / Б.В. Некрасов. − М. : Химия, 1981. – 560 с.
6. Романцева, Л.М. Сборник задач и упражнений по общей химии / Л.М. Романцева, З.Л. Лещинская, В.А. Суханова. – М. : Высшая школа, 1980. – 228 с.
Учебное издание
Макрушина Татьяна Ивановна
Верещагин Александр Леонидович
