Авторы задач – Ванин А.А. (№ 1), Байгозин Д.В. и
Бегельдиева С.М. (№№ 2 – 4), Гусев И.М. (№ 5)
1-1. Как известно, сумма степеней окисления всех элементов в любом соединении должна быть равна нулю. Основываясь на данном положении, определите степени окисления каждого элемента в соединениях, формулы которых: NH4NO3, HClO4, KCl, BaMnO4, Na2SO3.
1-2. Как известно, сумма степеней окисления всех элементов в любом соединении должна быть равна нулю. Основываясь на данном положении, определите степени окисления каждого элемента в соединениях, формулы которых: NH4ClO4, H2SO4, Na2S, AlPO4, KNO3.
2-1. Атом элемента Х имеет электронную конфигурацию 1s22s22p63s23p63d104s24p65s2. Определите химический элемент, установите формулы его оксида и гидроксида. Каковы кислотно-основные свойства этих соединений? Ответ проиллюстрируйте уравнениями реакций.
2-2. Атом элемента Y имеет электронную конфигурацию 1s22s22p63s23p63d104s24p64d105s25p66s2. Определите химический элемент, установите формулы его оксида и гидроксида. Каковы кислотно-основные свойства этих соединений? Ответ проиллюстрируйте уравнениями реакций.
3-1. В 120 г воды растворили 40 г пятиводного сульфата меди (II). Рассчитайте массовую долю сульфата меди в полученном растворе.
3-2. В 200 г воды растворили 40 г семиводного сульфата магния. Рассчитайте массовую долю сульфата магния в полученном растворе.
4-1. Некий бесцветный газ Х легче воздуха. Известно, что он горит в кислороде, может образовывать с ним взрывоопасную смесь, восстанавливает медь из ее оксида. В лаборатории этот газ получают взаимодействием металлов с кислотами. Определите газ Х, приведите его название. Напишите уравнения упомянутых в тексте задания трех реакций.
4-2. При исследовании твердого вещества Y было установлено, что при нагревании оно разлагается с образованием бесцветного газа, вызывающего помутнение известковой воды, и оксида металла, который называют "негашеной известью". "Негашеная известь" может присоединить молекулу воды с образованием "гашеной извести". Установите формулу вещества Y, приведите его название. Напишите уравнения упомянутых в тексте задания трех реакций, укажите признаки протекания этих процессов.
5-1. Расставьте коэффициенты в приведенных ниже схемах реакций. Укажите признаки их протекания.
1) Na3PO4 + CaCl2 → Ca3(PO4)2 + NaCl
2) K2SO4 + BaCl2 → BaSO4 + KCl
3) H2 + N2 → NH3
4) Fe + O2 → Fe2O3
5) CO2 + Na2O + H2O → NaHCO3
5-2. Расставьте коэффициенты в приведенных ниже схемах реакций. Укажите признаки их протекания.
1) FeCl3 + Na2SiO3 → Fe2(SiO3)3 + NaCl
2) Ca(NO3)2 + Na2CO3 → CaCO3 + NaNO3
3) Fe + O2 → Fe3O4
4) Н2 + O2 → Н2O
5) (NH)2Cr2O7 → N2 + H2O + Cr2O3
Класс
Авторы задач – Злотников Э.Г. (№№ 1 – 3, 5), Башмаков В.Я. и
Ванин А.А. (№ 4)
1-1.Укажите, с какими из приведенных ниже веществ водный раствор серной кислоты не реагирует. Ответ запишите в виде последовательности цифр, расположенных в порядке возрастания. Приведите также уравнения реакций между разбавленной серной кислоты и теми из перечисленных ниже веществ, которые с ней взаимодействуют.
Вещества:
1) Медь;
2) Ангидрид кремниевой кислоты;
3) Мрамор;
4) Цинк;
5) Фосфат кальция;
6) Сульфид железа(II);
7) Нитрат бария;
8) Гидрокарбонат лития;
9) Хлорид калия;
10) Сульфат натрия.
1-2.Укажите, с какими из приведенных ниже веществ соляная кислота не реагирует. Ответ запишите в виде последовательности цифр, расположенных в порядке возрастания. Приведите также уравнения реакций между соляной кислотой и теми из перечисленных ниже веществ, которые с ней взаимодействуют.
Вещества:
1) Медь;
2) Углекислый газ;
3) Малахит;
4) Железо;
5) Фосфат магния;
6) Нитрат серебра;
7) Нитрат калия;
8) Гидроксид бария;
9) Фосфорный ангидрид;
10) Оксид лития.
2-1. «Химический фонтан»
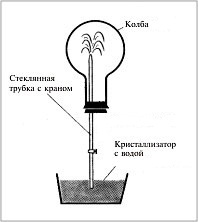 Колба, заполненная при нормальных условиях бромоводородом, герметично закрыта пробкой, в которую вставлена стеклянная трубка с закрытым краном. Колбу перевернули вверх дном, конец трубки опустили в сосуд с водой и открыли кран. Вода поднимается по трубке, фонтаном бьет в колбу и полностью колбу заполняет. Объясните происходящие в этом опыте явления. Какова массовая доля бромоводорода в полученном растворе?
Колба, заполненная при нормальных условиях бромоводородом, герметично закрыта пробкой, в которую вставлена стеклянная трубка с закрытым краном. Колбу перевернули вверх дном, конец трубки опустили в сосуд с водой и открыли кран. Вода поднимается по трубке, фонтаном бьет в колбу и полностью колбу заполняет. Объясните происходящие в этом опыте явления. Какова массовая доля бромоводорода в полученном растворе?
2-2. «Химический фонтан»
Колба, заполненная при нормальных условиях аммиаком, герметично закрыта пробкой, в которую вставлена стеклянная трубка с закрытым краном. Колбу перевернули вверх дном, конец трубки опустили в сосуд с водой и открыли кран. Вода поднимается по трубке, фонтаном бьет в колбу и полностью колбу заполняет. Объясните происходящие в этом опыте явления. Какова массовая доля аммиака в полученном растворе?
3-1. Твердое вещество А желтого цвета, реагируя с газом Б без цвета и запаха, образует бесцветный газ В с резким запахом. Последний в присутствии катализатора реагирует с избытком газа Б, образуя твердое при обычных условиях вещество Г. При растворении вещества Г в воде образуется сильная минеральная кислота, способная обугливать органические вещества. Определите вещества А, Б, В, Г. Напишите уравнения указанных реакций.
3-2. При определенных условиях два газообразных простых вещества А и Б, без цвета и запаха, взаимодействуют между собой с образованием нового бесцветного газа В. Последний легко реагирует с избытком газа Б, в результате чего появляется бурый газ Г, изменяющий окраску растворенного в воде лакмуса с фиолетовой на красную. Определите вещества А, Б, В, Г. Напишите уравнения указанных реакций.
4-1. При сжигании 3,6 г некоторого вещества X, содержащего углерод, водород и металл, получено 3,36 л (н.у.) CO2, 4,05 г воды и 2,55 г белого порошка. Определите простейшую формулу исходного вещества X и запишите уравнение реакции горения этого вещества.
4-2. При сжигании 6,15 г некоторого вещества Y, содержащего углерод, водород и металл, получено 4,48 л (н.у.) CO2, 4,5 г воды и 4,05 г белого порошка. Определите простейшую формулу исходного вещества Y и запишите уравнение реакции горения этого вещества.
5-1.Пять литров смеси аммиака и метана (н.у.) с плотностью 0,748 г/л пропустили через 164 г 10%-ного раствора серной кислоты. Какое вещество кристаллизуется при медленном испарении получившегося раствора? Какая масса этого вещества образуется?
5-2. Смесь азота и углекислого газа объемом 2,24 л (н.у.) с относительной плотностью по воздуху 1,103 пропустили через 17,5 г 8%-ного раствора гидроксида калия. Какое вещество кристаллизуется при медленном испарении получившегося раствора? Какая масса этого вещества образуется?
Класс
