Авторы задач – Скрипкин М.Ю. (№№ 1 – 4), Ростовский Н.В. (№№ 5, 6), Байгозин Д.В. (№7)
1-1. В пронумерованных пробирках 1-3 находится один из двух наборов солей А и В:
А) ZnSO4 и NaBr; NaCl и Ca(NO3)2; MgSO4 и NH4Cl
B) KNO3 и Na2CO3; KCl и MgSO4; NH4Cl и Ba(NO3)2
Определите содержимое каждой пробирки с помощью следующих реактивов и приспособлений: конц. соляная кислота, конц. серная кислота, сульфат железа(II), конц. гидроксид натрия, хлорид аммония, сульфат меди, хлорид бария, нитрат серебра, перманганат калия, дистиллированная вода, фенолфталеин, метилоранж, платиновая проволока. Приведите уравнения соответствующих реакций.
1-2. В пронумерованных пробирках 1-3 находится один из двух наборов солей А и В:
А) AlCl3 и KBr; CaCl2 и NaNO3; ZnCl2 и (NH4)2SO4
B) MgCl2 и KNO3; K2CO3 и ZnSO4; NaCl и Al(NO3)3
Определите содержимое каждой пробирки с помощью следующих реактивов и приспособлений: конц. соляная кислота, конц. серная кислота, сульфат железа(II), конц. гидроксид натрия, хлорид аммония, сульфат меди, хлорид бария, нитрат серебра, перманганат калия, дистиллированная вода, фенолфталеин, метилоранж, платиновая проволока. Приведите уравнения соответствующих реакций.
2-1. В вакуумированную ампулу объемом 100 мл поместили 20,0 г порошка карбоната магния (плотность 2,9 г/см3), подсоединили ампулу к манометру, нагрели до 300 оС и выдержали при этой температуре в течение недели. При этом в ампуле установилось давление 420 мм ртутного столба. Опыт повторили, взяв в 2 раза больше соли. Каким будет давление в ампуле в этом случае?
2-2. В вакуумированную ампулу объемом 100 мл поместили 10,0 г порошка карбоната магния (плотность 2,9 г/см3), подсоединили ампулу к манометру, нагрели до 300 оС и выдержали при этой температуре в течение недели. При этом в ампуле установилось давление 420 мм ртутного столба. Опыт повторили, взяв ампулу в 2 раза меньшего объема. Каким будет давление в ампуле в этом случае?
3-1. Юный Химик нашел в шкафу в химической лаборатории банку с полуистлевшей этикеткой. От надписи осталось только слово: «Гидроксид….». Чтобы определить содержимое банки, Юный Химик взял навеску вещества массой 0,250 г, растворил ее в воде, добавил фенолфталеин и начал порциями по 5,0 мл добавлять соляную кислоту концентрацией 0,1 моль/л. Оказалось, что раствор обесцветился после добавления к раствору 30,0 мл кислоты. Этих данных для Юного Химика оказалось достаточно, чтобы определить исходное вещество. Как он смог это сделать? Какой альтернативный способ определения данного вещества Вы могли бы предложить?
3-2. Юный Химик нашел в шкафу в химической лаборатории банку с полуистлевшей этикеткой. От надписи осталось только слово: «Гидроксид….». Чтобы определить содержимое банки, Юный Химик взял навеску вещества массой 0,200 г, растворил ее в воде, добавил метилоранж и начал порциями по 3,0 мл добавлять раствор азотной кислоты концентрацией 0,1 моль/л. Оказалось, что при добавлении 30,0 мл раствора кислоты индикатор еще имел желтый цвет, а при добавлении 33,0мл раствора кислоты он стал красным. Этих данных для Юного Химика оказалось достаточно, чтобы определить исходное вещество. Как он смог это сделать? Какой альтернативный способ определения данного вещества Вы могли бы предложить?
4-1. В водный раствор, содержащий равное количество вещества (эквимолярное количество) нитратов серебра, железа (III) и магния (объем раствора 100 мл, плотность 1,04 г/мл), поместили медную пластинку массой 30,0 г. По окончании реакции металлическую пластинку вынули из раствора, ополоснули дистиллированной водой, высушили и взвесили. Оказалось, что масса пластинки изменилась по сравнению с первоначальной на 0,5 г. Определите массовые доли всех веществ в растворе по окончании реакции.
4-2. В водный раствор, содержащий равное количество вещества (эквимолярное количество) нитратов ртути (II), железа (III) и кальция (объем раствора 100 мл, плотность 1,06 г/мл), поместили оловянную пластинку массой 30,0 г. По окончании реакции пластинку вынули из раствора, ополоснули дистиллированной водой, высушили и взвесили. Оказалось, что её масса изменилась на 0,6 г. Определите массовые доли всех веществ в растворе по окончании реакции.
5-1. На полное сгорание 0,1 моль алкана Х израсходовано 27,0 л (p = 101 кПа, t = 25 °С) кислорода. Известно, что Х имеет четвертичный атом углерода, а при его хлорировании на свету может образоваться три монохлорпроизводных, являющихся структурными изомерами. Определите брутто-формулу Х, предложите возможные структурные изомеры Х, удовлетворяющие условию задачи, назовите их по номенклатуре ИЮПАК. Какова структура монохлорпроизводного Х, образующегося в указанных условиях в наибольшем количестве?
5-2. На полное сгорание 0,2 моль алкана Х израсходовано 55,4 л (p = 100 кПа, t = 30 °С) кислорода. Известно, что Х не имеет четвертичных атомов углерода, а при его бромировании на свету может образоваться три монобромпроизводных, являющихся структурными изомерами. Определите брутто-формулу Х, предложите возможные структурные изомеры Х, удовлетворяющие условию задачи, назовите их по номенклатуре ИЮПАК. Какова структура монобромпроизводного Х, образующегося в указанных условиях в наибольшем количестве?
6-1. Расшифруйте представленную схему превращений и приведите названия соединений A – E по номенклатуре ИЮПАК. Соединения A – E являются основными продуктами реакций.
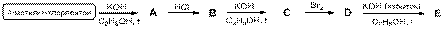
6-2. Расшифруйте представленную схему превращений и приведите названия соединений A – E по номенклатуре ИЮПАК. Соединения A – E являются основными продуктами реакций.
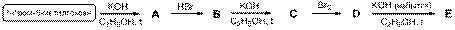
7-1. Экспериментальная задача (в оригинале была представлена в виде слайд-шоу).
В лабораторию поступил водный раствор пероксида водорода неизвестной концентрации. Плотность раствора составила 1,02 г/мл. Для определения концентрации был выбран метод окислительно-восстановитель-ного титрования. При помощи пипетки и спринцовки была отобрана аликвота раствора пероксида объемом 1,0 мл. Содержимое пипетки было количественно перенесено в коническую колбу, содержащую ~10 мл дистиллированной воды. К раствору в колбе было добавлено ~2 мл серной кислоты 1:5. Бюретка на 25 мл с ценой деления 0,05 мл была заполнена раствором перманганата калия с точной концентрацией 0,0610 моль/л.
Уровень раствора в бюретке был доведен до значения 0 мл (по верхнему мениску). Титрант по каплям, при перемешивании прибавляли к исследуемому раствору. За добавленным объемом следили по делениям на бюретке. Раствор обесцвечивался через несколько секунд после добавления очередной капли.
Через какое-то время раствор приобрел неисчезающую розовую окраску (от 1 капли). При этом объем добавленного титранта составил 8,05 мл. Бюретку снова заполнили раствором перманганата калия, отобрали аликвоту раствора пероксида водорода и повторили эксперимент (всего проведено три титрования). Объем титранта до появления устойчивой розовой окраски составлял: 8,05 мл; 8,10 мл; 8,10 мл.
1) Напишите уравнение протекавшей реакции.
2) Рассчитайте массовую долю пероксида водорода в исходном растворе.
3) Как можно было увеличить точность этого анализа?
4) На протекание реакции (обесцвечивание) в процессе титрования тратится некоторое время. Как можно ускорить этот процесс?
7-2. Экспериментальная задача (в оригинале была представлена в виде слайд-шоу).
В лабораторию поступил водный раствор оксалата аммония неизвестной концентрации. Плотность раствора составила 1,10 г/мл. Для определения концентрации был выбран метод окислительно-восстановительного титрования. При помощи пипетки и спринцовки была отобрана аликвота раствора оксалата объемом 1,0 мл. Содержимое пипетки было количественно перенесено в коническую колбу, содержащую ~10 мл дистиллированной воды. К раствору в колбе было добавлено ~3 мл серной кислоты 1:5. Бюретка на 25 мл с ценой деления 0,05 мл была заполнена раствором перманганата калия с точной концентрацией 0,0101 моль/л.
Уровень раствора в бюретке был доведен до значения 0 мл (по верхнему мениску). Титрант по каплям, при перемешивании прибавляли к исследуемому раствору. За добавленным объемом следили по делениям на бюретке. Раствор обесцвечивался через несколько секунд после добавления очередной капли.
Через какое-то время раствор приобрел неисчезающую розовую окраску (от 1 капли). При этом объем добавленного титранта составил 8,25 мл. Бюретку снова заполнили раствором перманганата калия, отобрали аликвоту раствора оксалата аммония и повторили эксперимент (всего проведено три титрования). Объем титранта до появления устойчивой розовой окраски составлял: 8,25 мл; 8,30 мл; 8,25 мл.
1) Напишите уравнение протекавшей реакции.
2) Рассчитайте массовую долю оксалата аммония в исходном растворе.
3) Как можно было увеличить точность этого анализа?
4) На протекание реакции (обесцвечивание) в процессе титрования тратится некоторое время. Как можно ускорить этот процесс?
Класс
