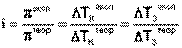Значения констант Е и К для некоторых растворителей
| Растворитель | Е | К |
| Вода | 0,516 | 1,86 |
| Бензол | 2,57 | 5,07 |
| Уксусная кислота | 3,1 | 3,6 |
Е и К являются экстраполяционными постоянными с размерностью град×моль–1×кг. Численно они равны изменению температур кипения и замерзания (кристаллизации) одномоляльных растворов, но на опыте их определять для одномоляльных растворов нельзя, так как такие растворы не являются разбавленными и законы идеальных растворов к ним не применимы.
Второй закон Рауля дает возможность определять молярные массы М г·моль–1 различных неэлектролитов в их разбавленных растворах.
Поскольку по определению моляльность раствора
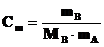 моль·кг –1,
моль·кг –1,
где mA – масса расворителя в кг, то можно записать
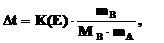
следовательно:
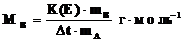 .
.
Таким образом, измерив температуру замерзания (или кипения) раствора, определяют молярную массу растворенного вещества.
Еще одной характеристикой идеальных растворов является осмотическое давление. Оно наблюдается на границе двух растворов с разными концентрациями, разделенных полупроницаемой перегородкой (мембраной), и обусловлено стремлением растворителя выровнять свою концентрацию по обе ее стороны. Процесс самопроизвольного перехода растворителя через полупроницаемую перегородку называется осмосом. Внешнее давление, которое надо приложить к раствору с большей концентрацией, чтобы осмос прекратился, называется осмотическим давлением. Таким образом, осмотическое давление p – внутреннее давление растворенного вещества, числено равное тому давлению, которое нужно приложить, чтобы прекратить осмос. Оно зависит от температуры и концентрации.
Эту зависимость Вант-Гофф уподобил поведению идеального газа
pV = R[7]T.
По Вант-Гоффу осмотическое давление раствора числено равно тому давлению, которое имело бы растворенноевещество, будучи переведено в газообразное состояние в том же объеме и при той же температуре.
Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа записывают в виде
p = СBRT.
Для разбавленных растворов СB–молярная концентрация растворенного неэлектролита.
Растворы с одинаковым осмотическим давлением называют изотоническими. С помощью закона Вант-Гоффа можно вычислить молярные массы растворенных веществ. Заменив величину CB в формуле Вант-Гоффа отношением 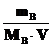 , где mB– масса растворенного вещества (в граммах) в объеме V(в литрах), получим уравнение
, где mB– масса растворенного вещества (в граммах) в объеме V(в литрах), получим уравнение
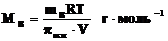 ,
,
позволяющее определить молекулярную массу растворенного неэлектролита.
Законы Рауля и Вант-Гоффа могут быть применены и к разбавленным растворам электролитов, если ввести в соответствующие уравнения поправочный множитель i, названный изотоническим коэффициентом Вант-Гоффа.
Изотонический коэффициент учитывает диссоциацию электролитов, в результате которой число частиц в растворе увеличивается, а величина i становится больше единицы.
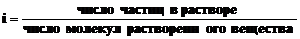
И тогда
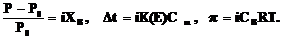
Примеры решения задач
1. Какова температура кипения раствора 30 г глюкозы (С6H12O6) в 100 мл воды (d = 1,000 г·мл–1, 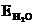 = 0,52 град·моль–1·кг).
= 0,52 град·моль–1·кг).
Решение:
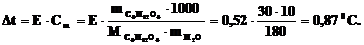
tкип раствора С6H12O6 равна 100,870С.
2. Температура замерзания раствора 0,4г неизвестного углеводорода в 25,0г уксусной кислоты понизилась на 0,45oС по сравнению с чистой CH3COOH (К = 3,6 град·моль–1·кг).
Какова молярная масса исследуемого углеводорода? Какова его формула, если по данным анализа содержание С = 93,76%; H = 6,25%?
Решение:
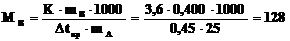 г×моль–1,
г×моль–1,
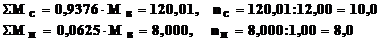
Исследуемый углеводород: C10H8 (нафталин).
3. Образец поливинилхлорида массой 4,00 г с М 1,5·105 г·моль–1 растворили в 0,1 л диоксана, С4H8O2, при 298К. Каково осмотическое давление возникающее в растворе по сравнению с чистым диоксаном? (R=8,31·103 Па·л·К–1·моль–1).
Решение: 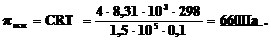
Вопросы для самопроверки
1. Какие растворы называют идеальными? Сформулируйте законы идеальных растворов.
2. Каков физический смысл криоскопической и эбулиоскопической констант?
3. В чем состоит явление осмоса?
4. Одинаковы ли окажутся температуры замерзания растворов, полученных прибавлением 90г воды к 10г неэлектролита:
а) метанола, CH3OH; б) этиленгликоля, C2H4(OH)2; в) глицерина, C3H5(OH)3?
5. При растворении 0,145 г белка в 10 мл воды при 250С возникает осмотическое давление 1002 Па. Какова молярная масса этого белка (R=8,31×103 Па·л·К–1·моль–1)?
Ответ: 35800 г·моль–1.
Электролиты.
Электролиты – соли, кислоты, основания, имеющие полярные и ионные связи, – при растворении в воде в той или иной мере диссоциируют (распадаются на ионы).
Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита пользуются понятием степени электролитической диссоциации (ионизации). Степень электролитической диссоциации α равна отношению числа (концентрации, Сд) диссоциированных молекул Nд. к общему числу (концентрации, Со) молекул Nо растворённого вещества
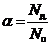
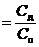 .
.
Степень электролитической диссоциации принято выражать либо в долях единицы, либо в процентах.
Степень диссоциации электролита в водных растворах зависит от природы электролита, концентрации, наличия других растворённых веществ и температуры. Повышение температуры и уменьшение концентрации раствора увеличивает степень диссоциации, которая в бесконечно разбавленных растворах приближается к единице.
По степени диссоциации электролиты условно можно разделить на три группы: сильные, средней силы и слабые. Принято считать сильными электролитами те, для которых α ≥ 30%, слабыми – если α ≤ 3% и средней силы – если 3% < α < 30%, причём все указанные значения α относятся к децимолярным (0,1 М) растворам электролитов при 25 оС. Более строгое разделение электролитов на сильные и слабые основано на значениях констант диссоциации.
Сильные электролиты в водных растворах существуют только в виде ионов. Истинная степень их ионизации близка к 1 (100%), хотя экспериментально наблюдаемая (кажущаяся) находится в пределах от 30% и выше. Особенности поведения сильных электролитов, проявляющиеся в уменьшении их активности в электрохимических процессах, обусловлены электростатическим взаимодействием ионов друг с другом и с растворителем, уменьшением подвижности образующихся сложных ассоциатов. К этой категории относят почти все простые соли, кислоты – HMnO4, HClO4, HNO3, HCl, HBr, HI, H2SO4, гидроксиды щелочных и щелочноземельных металлов.
Электролитами средней силы являются некоторые органические и неорганические кислоты (щавелевая Н2С2О4, муравьиная НСООН, сернистая Н2SO3, фосфорная Н3РО4 и др.).
К слабым электролитам принадлежат такие кислоты, как H2S, HCN, H3BO3, CH3COOH, Н2СО3, гидроксид аммония NH4OH, немногие соли (HgCl2, CdCl2, Fe(SCN)3).
Вследствие незначительной диссоциации (α < 3%) слабые электролиты в ионных уравнениях с их участием пишутся в молекулярной форме, например:
HCN + KOH = KCN + H2O,
HCN + OH– = CN– + H2O.
Степень диссоциации a можно связать с изотоническим коэффициентом i:
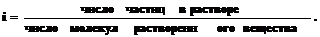
Если каждая молекула диссоциирует на n ионов, то N молекул дают naNионов, а непродиссоциированными остаются (1–a)Nмолекул. Тогда общее числочастиц в растворе равно (1–a)N+ naN.
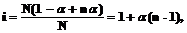 или
или 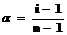 .
.
Экспериментально степень диссоциации можно определить по электропроводности, через изотонический коэффициент i (эбулиоскопическим или криоскопическим методами), рН-метрически.