Cильные электролиты. Активность
Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать, что для них изотонический коэффициент равен количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Однако, в действительности этот коэффициент всегда меньше определённого по формуле. Например, изотонический коэффициент для 0,05-моляльного раствора NaCl равен 1,9 вместо 2,0, для раствора сульфата магния той же концентрации и вовсе − 1,3). Это объясняет теория сильных электролитов: передвижение ионов в растворе затруднено образовавшейся оболочкой сольватации. К тому же, ионы взаимодействуют и между собой: разноимённо заряженные − притягиваются, а одноимённо заряженные — отталкиваются. Силы взаимного притяжения приводят к образованию групп ионов, перемещающихся по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле. Это сказывается, в частности, на его электропроводности.
Экспериментально определенные свойства растворов (Dtкип., Dtзам., p,), зависящие от общего числа частиц растворенного вещества, оказываются меньше рассчитанных в предположении полной диссоциации
Законы Рауля и Вант-Гоффа для таких растворов не выполняются.
Для учета межионных и межмолекулярных взаимодействий в растворе вводят понятие эффективной концентрации – активности (а),которая связана с аналитической концентрацией (С) соотношением
а = g × С, где g –коэффициент активности.
Активность –это мера реального поведения вещества в растворе. Коэффициент активности – характеризует степень отклонения свойств реального раствора от идеального и сложным образом зависит от концентрации.
В концентрированных растворах сильных электролитов он может быть > 1. Так, в 0,5н растворах NaOH, КОН, HCl, H2SO4 g соответственно равен 1,060; 1, 67; 2,38; 2,08.
В разбавленных растворах электролитовкоэффициент активности < 1 и приближается к 1 бесконечно разбавленных (табл. 6.2.).
Коэффициент активности зависит не только от концентрации данного электролита, но и от присутствия других ионов в растворе – ионной силы растворов J (табл. 6.3). Последняя определяется по формуле,
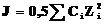 ,
,
где Ci – концентрация ионов, образующих раствор, моль×л–1; моль×кг–1 ; Zi – их заряды.
Для водных растворов с J < 0,01 коэффициент активности может быть определен по формуле
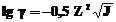 ,
,
а для растворов с 0,01< J<0,5 по формуле:
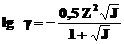 .
.
Таблица 6.2
Значения коэффициентов активности при различных концентрациях электролитов в водных растворах при температуре 20 0С
| Электролит | Формула | Коэффициенты активности, g | ||||||
| С, моль×л–1 | 0,001 | 0,005 | 0,01 | 0,1 | 0,5 | 1,00 | 2,00 | |
| Азотная кислота | HNO3 | 0,97 | 0,94 | 0,90 | 0,79 | 0,72 | 0,724 | 0,781 |
| Серная кислота | H2SO4 | 0,83 | 0,70 | 0,54 | 0,27 | 0,16 | 0,137 | 0,132 |
| Cоляная кислота | HCl | 0,97 | 0,94 | 0,90 | 0,80 | 0,77 | 0,81 | 1,01 |
| Гидроксид калия | KOH | 0,97 | 0,94 | 0,90 | 0,79 | 0,732 | 0,756 | 0,888 |
| Хлорид калия | KCl | 0,97 | 0,94 | 0,90 | 0,77 | 0,65 | 0,61 | 0,58 |
| Хлорид меди | CuCl2 | 0,89 | 0,81 | 0,71 | 0,52 | 0,43 | 0,419 | 0,468 |
| Сульфат меди | CuSO4 | 0,74 | 0,58 | 0,41 | 0,16 | 0,05 | 0,042 | – |
| Хлорид натрия | NaCl | 0,97 | 0,94 | 0,90 | 0,78 | 0,68 | 0,654 | 0,665 |
| Сульфат цинка | ZnSO4 | 0,70 | 0,54 | 0,39 | 0,15 | 0,06 | 0,05 | 0,04 |
Следовательно, средний коэффициент активности в разбавленных растворах электролитов зависит только от ионной силы и не зависит от природы ионов, находящихся в растворе.
Таблица 6.3
Коэффициент активности ионов в водных растворах с различной ионной силой.
 Заряд Заряд | Коэффициенты активности g при J | ||||||||
| иона J | 0,001 | 0,002 | 0,005 | 0,01 | 0,05 | 0,1 | 0,2 | 0,5 | |
| 0,97 | 0,95 | 0,93 | 0,90 | 0,81 | 0,76 | 0,70 | 0,62 | ||
| 0,87 | 0,81 | 0,74 | 0,66 | 0,44 | 0,33 | 0,24 | 0,15 | ||
| 0,73 | 0,63 | 0,51 | 0,39 | 0,15 | 0,08 | 0,04 | 0,014 |
Введение понятия активности позволяет, не выясняя сложной картины взаимодействия частиц в реальных растворах, оценить эффективность этого взаимодействия и использовать применительно к ним законы идеальных растворов и уравнения термодинамики.
 Константа равновесия сильного электролита АВ А+ +В–, вычисленная по активности веществ, называется термодинамической константой Кт в отличие от концентрационной (аналитической) константы К, вычисляемой по концентрациям и может быть записана так:
Константа равновесия сильного электролита АВ А+ +В–, вычисленная по активности веществ, называется термодинамической константой Кт в отличие от концентрационной (аналитической) константы К, вычисляемой по концентрациям и может быть записана так:
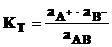 ,
,
где АВ – ионная пара, ассоциат сильного электролита (не молекула!).
Термодинамическая и концентрационная константы связаны соотношением:
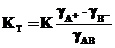 ,
,
т.е. при приближении g ® 1 значения Кт и К сближаются и становятся одинаковыми в бесконечно разбавленных растворах.
Активность и коэффициент активности можно определить различными способами: по электропроводности раствора, по осмотическому давлению, по понижению температуры замерзания и др.
