Правила заполнения электронами атомных орбиталей
Заселение электронами атомных орбиталей (АО) осуществляется согласно принципу наименьшей энергии, принципу Паули и правилу Гунда.
Принцип наименьшей энергии требует, чтобы электроны заселяли АО в порядке увеличения их энергии. Это отражает общие термодинамические тенденции – максимуму устойчивости системы соответствует минимум её энергии.
В многоэлектронных атомах электрон находится не только в поле ядра, но и в поле других электронов. Поэтому энергия электрона в многоэлектронных атомах определяется как главным, так и орбитальным квантовыми числами, увеличиваясь с их ростом, при этом влияние l (межэлектронного взаимодействия) тем значительнее, чем больше электронов содержит атом.
Самым низким по энергии является первый, ближайший к ядру энергетический уровень с n = 1.
Энергия подуровня определяется формой орбитали (квантовым числом l) и при одном и том же значении n возрастает с ростом l, т.е. энергия ns- подуровня < np < nd < nf.
Влияние квантового числа l на энергию электрона проявляется в частности через эффект экранирования и эффект проникновения электрона к ядру.
Эффект экранирования состоит в уменьшении воздействия на электрон положительного заряда ядра из-за наличия между рассматриваемым электроном и ядром других электронов. Экранирование возрастает с увеличением числа электронных слоёв, окружающих ядро. Оно ослабляет связь электрона с ядром, уменьшая эффективный (действующий) заряд ядра (Z эфф. < Z) и, тем самым, увеличивает энергию электрона. Влияние экранирования особенно заметно у s- элементов (I-А и II-А групп) и проявляется, в том числе, в значениях их орбитальных радиусов и энергий ионизации (рис. 1.4 и 1.5).
Экранированию противоположен эффект проникновения электрона к ядру (во внутренние слои), который понижает энергию электрона и увеличивает его связь с ядром, делая nэфф. ‹ n.
Общий результат притяжения внешних электронов к ядру зависит от относительного вклада экранирующего влияния внутренних электронных слоёв и проникающей способности валентных электронов.
Проникающая способность убывает в ряду: ns > np > nd >nf с усложнением формы орбиталей.
Разной проникающей способностью электронов можно объяснить тот факт, что в многоэлектронном атоме энергииподуровней (n-2)f, (n-1)d и ns близки между собой и всегда меньше, чем np. т.е. (n-2)f ≈ (n-1)d ≈ ns <np.
Заселение электронами атомных орбиталей происходит с учётом повышенной устойчивости подуровней p, d, f, когда они заполнены наполовину (неспаренными электронами) и полностью заполнены. Пониженной энергией и соответственно особой устойчивостью характеризуется конфигурация инертного газа ns2 и ns2np6 (октет).
Принцип Паули запрещает в многоэлектронном атоме находиться электронам с одинаковым набором квантовых чисел. Это означает, что два любых электрона в атоме (или молекуле и ионе) должны отличаться друг от друга значением хотя бы одного квантового числа, то есть на одной орбитали может быть не более двух электронов с различными спинами (спаренных электронов). Каждый подуровень содержит 2ℓ + 1 орбитали, на которых размещаются не более 2 (2ℓ + 1) электронов. Отсюда ёмкость s - орбиталей – два, р- орбиталей – шесть, d- орбиталей – десять и f- орбиталей – четырнадцать электронов.
Орбитали с одинаковыми энергиями (вырожденные) заполняются в соответствии с правилом Гунда: наименьшей энергией обладает электронная конфигурация с максимальным спином. Это означает, что если на р- орбиталях три электрона, то они располагаются так ↓ ↓ ↓ и суммарный спин S = 3/2, а не так ⇅ ↓ – , S = 1/2 .
Правило Гунда выведено на основании изучения атомных спектров. Квантовомеханическая природа этого правила основана на том, что электроны с разными значениями mℓ (в нашем примере –1, 0, +1) наиболее пространственно удалены друг от друга и энергия их электростатического отталкивания минимальна.
В записи электронных формул (или конфигураций) в соответствии с приведенными правилами, первая цифра означает энергетический уровень n, буква после неё – подуровень, а показатель степени – число электронов в этом состоянии. Например, электроннаые формулы атомов − лития − 1s22s1, углерода − 1s22s22p2, хлора − 1s22s22p63s23p5.
Если хотят показать распределение электронов не только на подуровне, но и на орбиталях, то представляют ор-
битальную диаграмму. Орбитали на диаграмме изображают
в виде квантовых ячеек (квадратов или горизонтальных линий). Электроны изображают в виде стрелок (рис.1.2).
Орбитальная диаграмма наглядно показывает, что в многоэлектронных атомах не только энергетические уровни но и подуровни различаются по энергии, то есть энергия электронов определяется как n-, так и ℓ- квантовыми числами; орбитали отличаются значениями mℓ, а у спаренных электронов различны только спины.
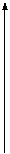 E C 1s22s22p2
E C 1s22s22p2
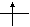
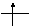 mℓ= – 1 mℓ = 0 mℓ= 1
mℓ= – 1 mℓ = 0 mℓ= 1

 2p2
2p2
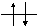 n=2 2s2
n=2 2s2


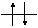 n=1 1s2
n=1 1s2
Рис.1.2. Орбитальная диаграмма атома углерода.
