Электронная оболочка атома. Квантовые числа
Строение атома в современной химии рассматривается с позиций квантовой механики, изучающей поведение микрообъектов. Согласно квантовой механике поведение электрона как микрочастицы основывается на трёх главнейших положениях:
1. Корпускулярно-волновая природа.
Соотношение «волна – частица» таково, что с уменьшением массы частицы её волновые свойства усиливаются. Волновые свойства электронов экспериментально подтверждены их дифракцией.
2. Квантовый характер энергетических изменений.
В системе микрообъектов энергия поглощается и испускается не непрерывно, а дискретно (скачкообразно), отдельными порциями – квантами и, следовательно, может принимать только определённые значения, кратные числам квантов.
3. Неопределённость положения и скорости.
Квантовая механика отказывается от уточнения положения электрона в пространстве и заменяет классическое понятие точного нахождения частицы (орбита) понятием статистической вероятности нахождения электрона в данной точке (или элементе объёма) пространства вблизи ядра. Иными словами, электрон как бы «размазан» вокруг ядра и образует той или иной формы электронное облако (орбиталь), плотность которого в каждой точке определяется вероятностью пребывания в ней электрона.
Движение электрона имеет волновой характер. Его можно описать с помощью волновой функции Y. В разных точках пространства Y имеет разные значения: Y = f (x, y, z). Квадрат волновой функции Y 2 характеризует вероятность нахождения электрона в данной точке пространства. Величина Y 2dV – вероятность нахождения электрона в элементе объёма dV.
Уравнение Шредингера связывает волновую функцию с потенциальной энергией электрона и его полной энергией. Наличие трёх степеней свободы движения электрона привело к появлению в решении уравнения Шредингера трёх квантовых чисел: n, ℓи mℓ, которые могут принимать только целые, зависящие друг от друга значения.
Волновую функцию Y, являющуюся решением уравнения Шредингера, можно рассматривать как математическое определение орбитали.
Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He+, Li2+ и т.д.). В этом случае энергия электрона
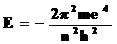 или
или 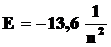 эВ,
эВ,
т.е. энергия электрона в атоме квантована.
n – принимает значения от 1 до ∞. Чем меньше n, тем ближе к ядру находится электрон и тем меньше его энергия, при этом энергия взаимодействия электрона с ядром наибольшая. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном.
В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q.
Орбитальное квантовое число ℓ характеризует форму орбиталей и определяет квантование орбитального момента количества движения электрона 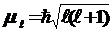 в сферически симметричном кулоновском поле ядра.
в сферически симметричном кулоновском поле ядра.
l принимает значения от 0 до n–1. Кроме числовых ℓ имеет буквенные обозначения.
. Значениеℓ 0 1 2 3 4
Букв. обозн. l s p d f g
(Подуровни)
Электроны с одинаковыми значениями n и ℓ образуют энергетический подуровень. Различают s–, p- d-и т.д.подуровни. Число подуровней в слое равно номеру энергетического уровня, т.е. в первом уровне – один подуровень (1s), во втором – два подуровня (2s и 2p), в третьем – три подуровня (3s, 3p и 3d), в четвёртом – четыре (4s, 4p, 4d, 4f).
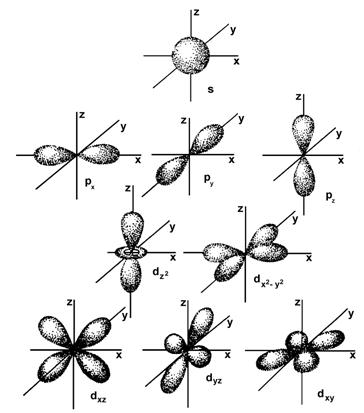
С точки зрения химии, формы орбиталей очень важны. Они показаны на рис. 1.1 и представляют граничную поверхность, внутри которой находится 90% электронного облака.
s- Орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Максимально симметричная форма их обусловлена тем, что при ℓ = 0 и μℓ = 0.
р- Орбитали существуют при n ≥ 2 и ℓ = 1. Их граничные поверхности имеют форму гантелей, т.е. состоят из двух областей, разделённых узловой плоскостью с нулевой плотностью вероятности нахождения в ней электрона. При переходе из одной области в другую волновая функция меняет знак.
d- Орбитали определяются квантовым числом ℓ = 2 (n≥ 3) и имеют более сложную форму.
f- Орбитали характеризуются квантовым числом ℓ = 3 (n ≥ 4) и изображаются в виде сложных восьмилепестковых структур. Их влияние на химические свойства заметны лишь у атомов тяжелых металлов.
Квантовое число mℓ называют магнитным. Оно определяет пространственное расположение атомной орбитали, которое характеризуется значением проекции вектора орбитального момента количества движения Mz на какую-либо ось координат (обычно на ось z) и принимает значения от – ℓ до + ℓ через нуль, то есть (2ℓ+ 1) значений, что соответствует числу орбиталей в подуровне.
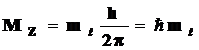
| Орбитальное квантовое число | Магнитное квантовое число | Число орбиталей с данным значением ℓ |
| ℓ | mℓ =(-l…0…+l) | (2ℓ + 1) |
| 0 (s) | ||
| 1 (р) | – 1, 0, +1 | |
| 2 (d) | –2, –1, 0, +1, +2 | |
| 3 (f) | –3, –2, –1, 0, +1, +2, +3 |
s– Состоянию отвечает одна орбиталь Сферические s – орбитали не направлены.
р- Орбиталей − три. Осями симметрии для р – орбиталей являются координатные оси, они расположены в пространстве под углом 900 и обозначаются рх, рy, рz.
d-Орбитали характеризуются пятью вариантами ориентации в пространстве. d- Орбитали, ориентированные лопастями по
осям координат, обозначают dz2и dx2–z2, а ориентированные по биссектрисам координатных углов – dxy, dyz, dxz.
а) s-, p-, d- орбитали
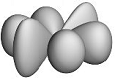
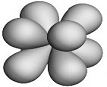
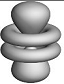
б) f- орбитали
Рис. 1.1. Формы и ориентация s-, p-, d- и некоторых f- электронных облаков
Орбитали одного подуровня (ℓ = const) имеют одинаковую энергию. Такое состояние называют вырожденным по энергии. Так, р- состояние вырождено трёхкратно, d- состояние − пятикратно, а f- состояние − семикратно.
Квантовые числа n, ℓ и mℓ не полностью характеризуют состояние электрона в атоме.
Экспериментально установлено, что электрон характеризуется еще одним квантовым числом – спином. Спин — это чисто квантовое свойство электрона, обусловленное дополнительной (внутренней) степенью свободы. Проекция спина на ось z(магнитное спиновое число ms) может иметь лишь два значения: ms = + ½ или ms - ½.
Итак, четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии.
