Электронная (атомная) орбиталь, ее основные характеристики(квантовые числа)
Основные понятия и законы в химии.
Предмет Н. Х.- изучает строение и свойства в-тв образованных всеми элементами периодической таблицы. Исключение составляют соединения С и Н названые углеводородами. Хим. Элемент- это совокупность атомов имеющих одинаковый положительный заряд ядра. Атом- это наименьшая частица хим. элемента являющаяся носителем его свойств. Молекула- наименьшая частица простого или сложного в-ва являющаяся носителем его свойств, молекулы образованы из атомов с помощью хим. связей. Моль- кол-во в-ва которое содержит столько структурных единиц сколько их содержится в 12г. изотопа углерода. Молярная масса- показывает массу одного моля. Эквивалент- кол-во которое соединяется с одним молем атома Н или замещает тоже количество атомов Н хим. реакций.
Хим. реакция- взаимодействие одного или нескольких в-тв в результате в исходных в-вах разрываются связи между атомами и образуются новые связи проводящие к образованию новых вещ-тв. Электро отрицательность- способность атома оттягивать на себя электронную плотность. Закон сохранения массы вещ-тв- масса вещ-тв вступивших в реакцию равна массе вещ-тв образовавшихся в результате реакции Закон постоянства состава- любое чистое вещ-во независимо от способов его получения имеет один и тот –же качественный и количественный состав. Закон эквивалентов- вещ-ва взаимодействуют между собой в кол-ве пропорциональных им эквивалентам. Закон простых объемных отношений- объемы вступающие в реакцию газа относятся к друг к другу а так же объему полученного газа как небольшие целые числа. Закон авагадра- в разных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул. Закон кратных отношений- если 2 элемента образуют несколько соединений то массовая кол-во одного элемента соединяющаяся с другим элементом относится между собой как небольшие целые числа.
3. Современная теория строения атома, корпускулярно- волновой дуализм частицмикромира. Уравнение Де-Бройля.
Н. Бор основоположник квантовой механики доказал что электроны атома движутся по закону микромира т.е. квантовой механики. На основании он придумал постулаты Бора:
1) Электрон может вращатся вокруг ядра но не полюбым а только по некоторым определенным круговым арбиталям.
2) Двигаясь по стационарной арбите электрон не излучает постоянную отрицательную энергию а излучает в том случае если переходит электрон с более дальней на болею ближнею арбиту.
Де-Бройль в 1924г. высказывает гипотизу о том что электроны при движении проявляют свойство волны и их повидение не может описывать классическая механика. Он доказал что электроны имеют двойственную природу и с 1 стороны электрон элементарная частица а с другой электронная волна. Дуализм электронов приводит к тому что движение в атоме не может быть описано при определенной траектории.
Корпускулярно-волновой дуализм- принцип, согласно которому любой объект может проявлять как волновые, так и корпускулярные свойства. Был введён при разработке квантовой механики для интерпретации явлений, наблюдаемых в микромире, с точки зрения классических концепций.
Уравнение Де- бройля: 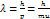 ,
,
Электронная (атомная) орбиталь, ее основные характеристики(квантовые числа).
Атомная орбиталь — одноэлектронная волновая функция в сферически симметричном электрическом поле атомного ядра, задающаяся главным n, орбитальным и магнитным m квантовыми числами.
Главное квантовое число n может принимать любые целые положительные значения, начиная с единицы и определяет общую энергию электрона на данной орбитали. Магнитное квантовое число m определяет проекцию орбитального момента импульса на направление магнитного поля и может принимать целые значения в диапазоне от -1 до 1. Орбитальное, побочное квантовое число L определяет энергию под уровня и форму орбитали.
5. Правила, в соответствии с которыми происходит заполнение электронных орбиталей атома в основном состоянии.
Принцип Паули- в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом.
Правило Клечковского- заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел n + l . При одинаковой сумме раньше заполняется орбиталь с меньшим значением n. Правило Хунда- это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон.
