Тема 6. Растворы электролитов
Вопросы для самоконтроля
1. Что называется ионным произведением воды? В каких пределах изменяется концентрация водородных и гидроксильных ионов в разбавленных водных растворах? Определите концентрацию ионов гидроксила, если концентрация ионов водорода равна 1,27·10-5 моль/л.
2. Изменится ли ионное произведение воды при повышении температуры? при приливании к раствору щелочи? кислоты?
3. Изменится ли и как рН раствора при повышении температуры? при приливании к раствору щелочи или кислоты?
4. Сравните величины степени диссоциации и константы диссоциации слабого электролита. Какая более полно оценивает его способность к диссоциации?
5. Как находят степень и константу диссоциации криоскопическим методом?
6. Концентрация водородных ионов в водном растворе равна 5,3×10-5 г-ион/л. Вычислите величину рН, концентрацию гидроксильных ионов и определите реакцию среды.
7. Используя понятие об активности, найти рН в 0,1 н растворе соляной кислоты; коэффициент активности равен 0,796.
8. Дайте определение кислот и оснований на основе теории электролитической диссоциации и на основе протилитической теории. Укажите на основе этих теорий кислоты и основания в процессах:
CH3COOH + Н2O = H3O++ СН3СОО-
NH3 + Н2O = NH4++ОН-
Пример 1. Вычислить ионную силу 0,4 М раствора сульфата натрия Na2SO4.
Решение. 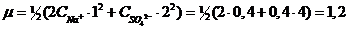
Произведение концентрации ионов водорода и гидроксила в любом растворе при данной температуре (22°C) остается постоянным и равным 10-14 г-ион/л. Это произведение называется ионным произведением воды:
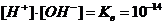
В нейтральной среде 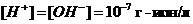 .
.
В кислой среде 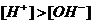 .
.
В щелочной среде 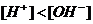 .
.
Для количественной характеристики среды обычно приводят не концентрацию водородных ионов, а применяют условный показатель, обозначенный через рН и называемый водородным показателем. Он представляет собой отрицательный десятичный логарифм концентрации (или активности) водородных ионов: 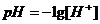 или
или 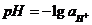 .
.
Тогда рН различных растворов будет иметь следующие значения: кислый - рН < 7; щелочной - рН > 7; нейтральный - рН=7.
Пример 2. [ОН-] =10-5 г-ион/л. Вычислить [Н+], рН и рОН.
Решение. [Н+]·[ОН] = 10-14, отсюда 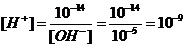
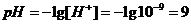 (рН > 7 - среда щелочная)
(рН > 7 - среда щелочная)
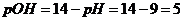
Ответ: [Н] = 10-5 г-ион/л; рН =9; рОН=5.
Пример 3. Вычислить рН 0,05 н раствора сильной одноосновной кислоты.
Решение. Так как кислота диссоциирована полностью и её концентрация невелика, поэтому в этом растворе активная концентрация будет равна имеющейся концентрации. Отсюда [H+] = 0,05 моль/л, тогда
рН =lg[H+] = -lg 0,05 = - lg 5·10-2 =-(lg 5+lg 10-2) = -0,70+2 = 1,3
Ответ: рН = 1,3
Пример 4. Вычислить рН буферного раствора, состоящего из 10 мл 0,1 М раствора CH3COONa. Константа электролитической диссоциации уксусной кислоты равна 1,85·10-5.
Решение. рН буферной смеси, состоящей из слабой кислоты и ее щелочной соли, рассчитываем по формуле:  ,
,
тогда рН = -lg l,85·10-5 + lg (90·0,1) - lg (10·0,1) = - (lg 1,85 + lg 10-5) +lg 9 - lg 1 = - 0,27 + 5 + 0,95 - 0 = 5,68
Ответ: рН (буферной смеси) = 5,68 (слабо кислая среда).
Задание 6 для контрольной работы
6.1. Вычислить осмотическое давление 0,1 М раствора хлорида калия при 20°C, изотонический коэффициент которого равен 1,92.
6.2. Определить осмотическое давление 0,01 М раствора бинарного электролита при 20°C, степень электролитической диссоциации которого равна 32%.
6.3. При какой температуре будет замерзать 1%-й водный раствор хлористого натрия, изотонический коэффициент которого равен 1,93?
6.4. Определить степень электролитической диссоциации 0,1 М раствора уксусной кислоты при 18°C, понижение температуры замерзания которого 0,189°C.
6.5. Что называют ионным произведением воды? В каких пределах измеряют концентрацию водородных и гидроксильных ионов в разбавленных водных растворах?
6.6. Концентрация водородных ионов в водном растворе равна 5,3·10-3 г-ион/л. Вычислить величину рН, концентрацию гидроксильных ионов и определить реакцию среды.
6.7. Что такое рН? Определить величину рН 0,1 н раствора соляной кислоты.
6.8. В каких пределах изменяется величина рН в разбавленных водных растворах? Привести значение рН в нейтральной, кислой и щелочной средах.
6.9. Концентрация водородных ионов в растворе равна 2,4·10-5 г-ион/л. Вычислить величину рН, концентрацию гидроксильных ионов и определить реакцию среды.
6.10. Величина рН водного раствора равна 4,75. Определить концентрацию водородных и гидроксильных ионов и реакцию среды.
6.11. Какие растворы называют буферными? В чем сущность буферного действия?
6.12. Что называется буферной емкостью? От чего зависит буферная емкость?
6.13. Вычислить рН буферного раствора, состоящего из равных объемов СН3СООН и CH3COONa одинаковой концентрации. Константа электролитической диссоциации уксусной кислоты при 25°C равна 7,6·10-5.
6.14. В каком соотношении надо взять растворы СН3СООН и CH3COONa одинаковой концентрации, чтобы получить буферный раствор с величиной рН, равной 4,75? Константа электролитической диссоциации уксусной кислоты при 25°C равна 1,85·10-5.
6.15. Вычислить рН ацетатной буферной смеси, состоящей из 2 и 1 н СН3СООН и 8 мл 1 н CH3COONa. Константа электролитической диссоциации уксусной кислоты при 25°C равна 1,85·10-5.
6.16. Вычислить рН фосфатной смеси, состоящей из 6 мл КН2РО4 (в качестве кислоты) и 4 мл К2НРO4 (в качестве соли) одинаковой концентрации. Константа электролитической диссоциации Н2РO4- при 25°C равна 1,54·10-7.
6.17. Определить концентрации ионов гидроксила в растворе вещества, если при 35°C рКв = 13,72, а рН = 7,34.
6.18. Во сколько раз концентрация водородных ионов в растворе с рН = 7,36 больше, чем в растворе, имеющем рН = 7,53?
6.19. Чему равна буферная емкость буферного раствора, если на титрование 5 мл его пошло 4 мл 0,1 н HCl? Сдвиг рН = 3.
6.20. К 100 мл буферного раствора для изменения рН от 7,36 до 7,0 надо добавить 3,6 мл 0,5 н соляной кислоты. Вычислить буферную емкость по кислоте.
6.21– 6.25. Сделайте расчеты величин рН по данным в таблице концентрациям или величин концентраций вещества по данным в таблице величинам рН. Расчеты сделайте для всех столбцов таблицы, относящихся к вашему варианту. Коэффициент активности в растворах сильных электролитов = 1.
| № задачи | Вещество | С, | СH+ | Сон- | pH | pOH |
| 6.21 | НС1 NaOH | 10-2 | 10,5 | |||
| 6.22 | HN03 NH4OH | 10-4 | 10-3 | |||
| 6.23 | СНзСООН КОН | 5∙10-2 | 10-9 | |||
| 6.24 | СНзСООН NaOH | 9,5∙1O-2 | ||||
| 6.25 | HN02 KOH | 1,5∙10-3 | 10-5 |
Тема 7. ЭЛЕКТРОХИМИЯ
Основные вопросы по теме
1. Возникновение электродного потенциала на границе металл-
электролит.
2. Уравнение Нернста.
3. Стандартный электродный потенциал.
4. Электроды первого и второго рода.
5. Уравнение Нернста для этих электродов.
6. Водородный электрод.
7. Гальванические цепи.
8. ЭДС гальванического элемента.
Вопросы для cамоконтроля
1. Как возникает и от чего зависит электродный потенциал на границе
металл – раствор?
2. Какие виды электродов вам известны?
3. Что такое «электроды сравнения»?
4. Как выглядит уравнение Нернста применительно к каждому виду
электродов?
5. Что такое ЭДС?
6. Как экспериментально определяют ЭДС?
7. Чем отличается гальванический элемент от аккумулятора?
8. Где используются гальванические элементы и аккумуляторы?
Электродный потенциал металла, погруженного в раствор его соли,
вычисляется по уравнению Нернста:
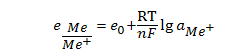
если раствор разбавлен, то
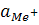 ≈С Ме+
≈С Ме+
Для 25 0С принимает вид
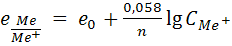
где n – число электронов в элементарной реакции (например, Zn0 - 2ē→Zn2+ n=2);
e0 – стандартный электродный потенциал, определяемый при условии
aМе+ = 1, Т = 298К, р= 1,013·105 Н/м2 (1 атм) (см. табл. 6);
С Me+ – концентрация, 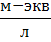 .
.
ЭДС – разность равновесных электродных потенциалов
Е = e1 – e2 (в).
При вычислении ЭДС из большего потенциала вычитается меньший, так как по определению ЭДС – величина положительная.
На электроде с большим потенциалом идет процесс восстановления:
Ме+n + n · ē→Ме0.
На электроде с меньшим потенциалом идет процесс окисления:
Ме0 – n · ē→Ме+n .
Примеры решения задач
Пример 1
Вычислить электродвижущую силу гальванического элемента, составленного из Ag/Ag+ (CM = 0,01 моль/л) и Cd/Cd2+ (СM = 0,05 моль/л).
Напишите протекающую реакцию. Стандартные потенциалы взять из таблицы.
Решение
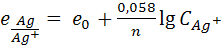 = +0,799 + 0,058 ⋅l g 0,01 = 0,799 + 0,058 ⋅(−2) = 0,683(в) ,
= +0,799 + 0,058 ⋅l g 0,01 = 0,799 + 0,058 ⋅(−2) = 0,683(в) ,
CAg + = CM = 0,01 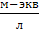 .
.
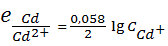 = − 0,402 + 0,029 ⋅ lg 0,1− 0,402 + 0,029 ⋅(−1) = − 0,431(в),
= − 0,402 + 0,029 ⋅ lg 0,1− 0,402 + 0,029 ⋅(−1) = − 0,431(в),
CCd2+ = 2 ⋅ CM = 0,1 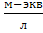 (см. тему 5).
(см. тему 5).
Вычисляем ЭДС:
E = 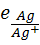 −
− 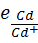 = 0,683 — ( - 0,431) = 1,114 в.
= 0,683 — ( - 0,431) = 1,114 в.
На серебряном электроде идет процесс восстановления:
Ag+ + ē= Ag0
На кадмиевом электроде идет процесс окисления:
Cd0 – 2ē= Cd2+.
Суммируем оба процесса с учетом коэффициентов:
2Ag+ + 2ē+ Cd0 – 2ē = 2Ag0 + Cd+2 ;
окончательно
2Ag+ + Cd0 = 2Ag0 + Cd+2 .
Задание 7 к контрольной работе
Вычислить электродвижущую силу окислительно-восстановительного элемента, составленного из двух полуэлементов А и В. Напишите протекающую в нем реакцию. Стандартные потенциалы взять из табл. 6.
| № п/п | Полуэлемент А | Концентрация С моль/л | Полуэлемент В | Концентрация С моль/л |
| 7.1 | Ag/AgNO3 | 0,10 | Zn/ZnSO4 | 0,20 |
| 7.2 | Ag/AgNO3 | 0,20 | Zn/ZnSO4 | 0,30 |
| 7.3 | Ag/AgNO3 | 0,30 | Zn/ZnCl2 | 0,10 |
| 7.4 | Ag/AgNO3 | 0,50 | Zn/Zn(NO3)2 | 0,20 |
| 7.5 | Cd/Cd(NO3)2 | 0,20 | Zn/Zn(NO3)2 | 0,30 |
| 7.6 | Cd/Cd(NO3 )2 | 0,70 | Zn/Zn(NO3)2 | 0,10 |
| 7.7 | Cd/Cd(NO 3)2 | 0,80 | Zn/ZnSO4 | 0,50 |
| 7.8 | Cd/Cd SO4 | 0,05 | Ni/NiSO4 | 0,70 |
| 7.9 | Cd/Cd SO4 | 0,20 | Ni/NiSO4 | 0,30 |
| 7.10 | Cd/Cd SO4 | 0,02 | Ni/NiSO4 | 0,05 |
| 7.11 | Cu/CuSO4 | 0,50 | Cd/Cd (NO )3 | 0,05 |
| 7.12 | Cu/CuSO4 | 0/01 | Cd/Cd (NO )3 | 0,20 |
| 7.13 | Cu/CuCl2 | 2,00 | Cd/Cd SO4 | 0,30 |
| 7.14 | Cu/CuCl2 | 0,20 | Pb/Pb (NO3)2 | 0,03 |
| 7.15 | Cu/CuCl2 | 0,06 | Pb/Pb (NO3)2 | 0,20 |
| 7.16 | Cu/CuCl2 | 0,02 | Pb/Pb (NO3)2 | 0,30 |
| 7.17 | Fe/FeSO4 | 0,2 | Ni/NiSO4 | 0,02 |
| 7.18 | Fe/FeSO4 | 0,02 | Cu/CuSO4 | 0,3 |
| 7.19 | Ni/NiSO4 | 0,10 | Co/Co (NO )3 | 0,05 |
| 7.20 | Ni/NiSO4 | 0,20 | Cu/Cu (NO )3 | 0,01 |
| 7.21 | Zn/ZnSO4 | 0,01 | Ag/AgNO3 | 0,01 |
| 7.22 | Zn/ZnSO4 | 0,02 | Ag/AgNO3 | 0,02 |
| 7.23 | Zn/ZnCl2 | 0,05 | Ag/AgNO3 | 0,30 |
| 7.24 | Zn/ZnCl2 | 0,01 | Ni/NiSO4 | 0,50 |
| 7.25 | Zn/ZnCl2 | 0/03 | Ni/Ni (NO )3 | 0,10 |
Таблица 6
Стандартные электродные потенциалы при 250С
| Электрод | Электродный процесс | Стандартный потенциал (в) |
| Ag/Ag | Ag+ +ē 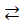 Ag0 Ag0 | + 0,799 |
| Cd/Cd2+ | Cd2+ + 2ē 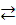 Cd0 Cd0 | - 0,402 |
| Co/Co2+ | Co2+ + 2ē 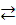 Co0 Co0 | - 0,270 |
| Cu/Cu2+ | Cu2+ + 2ē 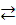 Cu0 Cu0 | + 0,340 |
| Ni/Ni2+ | Ni2+ + 2ē 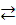 Ni0 Ni0 | - 0,240 |
| Pb/Pb2+ | Pb2+ + 2ē 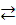 Pb0 Pb0 | - 0,126 |
| Zn/Zn2+ | Zn2+ + 2ē 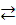 Zn0 Zn0 | - 0,760 |
Приемы нашей кулинарной техники, имеющей место
на кухне, являются ни чем иным как практическим
применением коллоидной химии.
Бехгольд
КОЛЛОИДНАЯ ХИМИЯ
Предмет коллоидной химии. Понятие о дисперсных системах и их классификация. Особенности коллоидных систем, методы их получения и очистки. Высокомолекулярные соединения (ВМС), сходство и различия растворов ВМС и дисперсных систем.
Коллоидная химия- это физикохимия гетерогенных систем, содержащих чаще всего 2 фазы. Одна фаза представляет собой высокодисперсные мельчайшие частицы вещества (агрегат из обычных молекул), или макромолекулы ВМС, и называется дисперсной фазой.Другая фаза, в которой распределены агрегаты дисперсных частиц или молекул, называется дисперсионной средой.Условием образования таких коллоидных систем (коллоидного состояния вещества) является нерастворимость одной фазы в другой.
Дисперсная фаза,состоящая из множества мельчайших частиц, имеет очень большую удельную поверхность раздела с дисперсионной средой.
Особые свойства поверхности раздела обусловливают специфические особенности дисперсных систем, что и является причиной выделения данной области знания в отдельную науку - коллоидную химию.
Основные отличительные особенности коллоидных систем от истинных растворов следующие:
1)способность к рассеиванию света;
2)медленная диффузия частиц дисперсной фазы в дисперсионной среде;
3)способность к диализу;
4) агрегативная неустойчивость дисперсной фазы, проявленная в виде выделения частиц из дисперсионной среды при добавлении к системе электролитов или под влиянием других внешних воздействий.
Гетерогенные высокодисперсные(ультрамикрогетерогенные) коллоидные системыхарактеризуются размерами частиц дисперсной фазы в интервале 10-5 - 10-7 см. Ниже этого интервала происходит переход от агрегатов к отдельным молекулам, т.е. к истинным растворам. При диаметре частиц более 10-5 см грубодисперсные системы называются микрогетерогенными. Это порошки, суспензии, эмульсии, пены и др. Микрогетерогенные системы в соответствии с проявляемыми ими свойствами также относятся к коллоидным, хотя подвижность таких крупных частиц в дисперсионной среде резко снижена.
Отметим, что для названия систем, степень дисперсности частиц у которых лежит в ультрамикрогетерогенной коллоидной области, используется общий термин - золь.
Если в жидкости распределена твердая фаза, то система (Т/Ж) называется суспензиейили коллоидным раствором(в зависимости от интервала размера частиц). Если фаза и среда - жидкости,то система (Ж/Ж) называется эмульсией,а в случае газообразной дисперсионной среды система (Ж/Г, Т/Г) носит название аэрозоль.
Системы, в которых энергетическое взаимодействие между дисперсной фазой идисперсионной проявляется слабо (например, частицы металлов или галогенидов серебра в воде), называются лиофобными (или в водной среде - гидрофобными,т.е. не любящими воду).
Если же вдисперсной системе интенсивность молекулярных взаимодействий на границе раздела фаз является сильно выраженной (например, в растворах ВМС, белков), то такие системы называются лиофильными(или в водной дисперсионной среде - гидрофильными,т.е. любящими воду). Коллоидными свойствами могут обладать системы как с неорганогенными, так и с органогенными фазовыми компонентами.
Тема 8. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ В ДИСПЕРСНЫХ СИСТЕМАХ
Вопросы для самопроверки
1. Понятие об адсорбции. Природа адсорбционных сил.
2. Связь между адсорбцией и поверхностной энергией. Уравнение Гиббса (вывод уравнения).
3. Поверхостно-активные вещества и их слои на поверхности полярных (воды) и неполярных (бензола) жидкостей.
4. Изотерма адсорбции Фрейндлиха и Лэнгмюра (вывод уравнения).
5.Ионообменная адсорбция.
6. Роль обменной адсорбции в жизни растений и почвы.
7. Молекулярная адсорбция из растворов. Причины различной адсорбционной способности молекул.
8. Ионная и ионообменная адсорбция. Причины различной адсорбционной способности ионов.
9. Хроматографический анализ, разработанный Цветом. Принцип метода.
10. Различные виды хроматографического анализа. Методика их проведения.
Задание 8 к контрольной работе
8.1. Что называется адсорбцией? Чем она обусловлена и какими уравнениями описывается?
8.2. В чем состоят особенности строения молекул ПАВ и ПИВ и их адсорбция?
8.3. Чем отличается физическая адсорбция от хемосорбции?
8.4. Перечислите особенности ионной адсорбции. Как она зависит от размеров и зарядов ионов?
8.5. Какие методы получения дисперсных систем вы знаете?
10.6. Какие оптические методы используют для определения размеров частиц дисперсной фазы?
8.7. Какие явления называются электрокинетическими? Перечислите их, пояснив сущность протекающих процессов.
8.8. Изобразить процесс деминерализации воды с помощью ионитов.
8.9. Вычислить по уравнению Лэнгмюра Γ при 292°K для следующих концентраций растворов изоамилового спирта (моль/л): 0,1; 0,2; 0,3; 0,4; 0,5. Γmax = 8,7·10-9 моль/см2, К = 42.
8.10. Описать адсорбцию на жидкой поверхности и привести соответствующее уравнение.
8.11. Написать уравнение изотермы адсорбции Лэнгмюра и Фрейдлиха. Объяснить значение входящих в них величин. Дать графическое изображение зависимости адсорбции от концентрации при постоянной температуре.
8.12. В чем сущность обменной адсорбции? Что такое катиониты и аниониты? Написать уравнение ионного обмена с использованием катионитов и анионитов.
8.13. Дать определение поверхностной энергии и поверхностного натяжения.
8.14. Описать адсорбцию на жидкой поверхности и привести соответствующее уравнение.
8.15. Какие вещества называют поверхностно-активными и поверхностно-неактивными? Привести примеры.
8.16. В чем заключается правило Дюкло-Траубе? Проиллюстрировать его примерами.
8.17. Применение суспензий в пищевой промышленности.
10.18. Какие системы называются эмульсиями? Как они классифицируются и где применяются?
8.19. Какие вы знаете факторы устойчивости пены? Как можно предотвратить образование пены в технологическом процессе?
8.20. Какими методами можно разрушать аэрозоли?
8.21. Что такое «порошок»? Как получают и как классифицируют?
8.22. Какую адсорбцию называют специфической (избирательной)? В чем заключается правило Панета-Фаянса? Привести примеры лиотропных рядов ионов.
8.23. В чем сущность хроматографии? Каково ее практическое значение?
8.24. Чем отличается эластичный студень от хрупкого геля? Что такое
«тиксотропия»?
8.25. Почему гидрофобные вещества (уголь, графит) лучше адсорбируют поверхностно-активные вещества из водных растворов, а гидрофильные (фолинагель) - из углеводородных?
Тема 9. ДИСПЕРСНЫЕ СИСТЕМЫ
Примеры решения задач
Пример 1
Коллоидный раствор получен в результате реакции обмена при
смешении равных объемов растворов:
а) 0,001 н Pb(NO3)2 и 0,0005 н HJ;
б) 0,01 н Pb(NO3)2 и 0,02 н HJ.
Определить, какой из двух электролитов (K2SO4 или CaCl2) будет иметь меньший порог коагуляции.
Решение:
1. Пишем уравнение реакции:
Pb(NO3)2 +2HJ = PbJ2 ↓+2HNO3 .
При заданных концентрациях будет избыток Pb(NO )3 . В результате реакции в растворе останутся следующие ионы: Pb2+, H+ , NO3-.
Твердые частицы PbJ2 будут составлять ядро мицеллы золя. Поскольку неизвестно, сколько молекул PbJ2 составят ядро, то ставят
коэффициент m. Таким образом, ядро – m PbJ2 .
В соответствии с правилом избирательной адсорбции ионов Пескова-Фаянса на поверхности ядра будут адсорбироваться ионы Pb2+. Сколько – неизвестно, поэтому ставят коэффициент n.
Поэтому адсорбционный слойсостоит из n Pb+2 . В результате адсорбции ядро приобретает положительный заряд (равный +2n). За счет
электрического взаимодействияк положительно заряженному ядру будут
притягиваться отрицательно заряженныеионы, т.е. NO3−; образуется слой
противоионов. Известно (см. учебник), что полной компенсации заряда ядра в слое противоионов не происходит. Поэтому ставят коэффициент 2(n-x).
Впереди коэффициент 2, так как для нейтрализации одного иона Pb2+ необходимо два иона NO3 −.
Слой противоионов 2 (n-x) NO3−.
Сумма зарядов адсорбционного слоя и слоя противоионов будет составлять заряд гранулы:
(+2)· n + (-1) · (2) · (n - x) = +2n - 2n + 2x = +2x.
Окончательная нейтрализация заряда адсорбционного слоя ионов
происходит в диффузионном слое ионов. Поскольку заряд гранулы +2х, то
для нейтрализации понадобится 2·х отрицательно заряженных ионов NO3 −.
В итоге диффузионный слой 2x NO3-. Составляем формулу мицеллы золя:
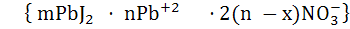 +2x⋅ 2x NO3
+2x⋅ 2x NO3




ядро аддсоб. слой слой протовоионов диф. слой
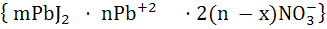 +2 - гранула
+2 - гранула
 |  | ||||
 | |||||
ядро аддсоб. слой слой протовоионов
В соответствии с правилом Шульце-Гарди:
1) коагулирующий ион должен иметь заряд, противоположный заряду гранулы;
2) чем выше заряд иона, тем выше его коагулирующая способность.
Коагулировать этот золь будут отрицательно заряженные ионы.
Выше заряд у ионов SO2−. Поэтому меньший порог коагуляции будет иметь K2SO4 .
2. В результате реакции при заданных концентрациях, в растворе
останутся ионы: H+, J-, NO3- .
Ядро – mPbJ2 .
В соответствии с правилом Пескова-Фаянса будут адсорбироваться ионы J-.
Адсорбционный слой - n J- .
Слой противоионов (n -x)H+.
Заряд гранулы (-1) · n + (+1)(n - x) = -x.
Диффузионный слой х · Н+.
Составим схему строения мицеллы золя:
{ mPbJ2 nJ- (n −x)H+}-2 xH+
В соответствии с правилом Шульце – Гарди этот золь будут коагулировать положительно заряженныеионы. Выше заряд у иона Са2+. Поэтому меньше порог коагуляции будет иметь СаСl2.
Задание 9 к контрольным работам
Коллоидный раствор получен в результате реакции обмена при
смешении равных объемов растворов А и В разных концентраций. Напишите и объясните формулу мицеллы золя и схему ее строения. Определите,
какой из двух электролитов будет иметь меньший порог коагуляции.
| № п/п | Раствор А | Раствор В | Электролиты |
| 9.1 | 0,003 н AgNO3 | 0,002 н HJ | AlCl3, K3PO4 |
| 9.2 | 0,01 н AgNO3 | 0,002 н HJ | MgCl2, K2SO4 |
| 9.3 | 0,003н AgNO3 | 0,01 н H2S | Ca(NO3)2, Na2SO4 |
| 9.4 | 0,005 н AgNO3 | 0,001 н KJ | Ba(NO3)2 , K2SO4 |
| 9.5 | 0,008 н AgNO3 | 0,004 н HBr | Na2SO4, AlCl3 |
| 9.6 | 0,004 н AgNO3 | 0,008 н HBr | Ba(NO3)2, K2SO4 |
| 9.7 | 0,0007 н AgNO3 | 0,0001 н KBr | Ca(NO3)2, K2SO4 |
| 9.8 | 0,0001 н AgNO3 | 0,0008 н KJ | AlCl3, K2SO4 |
| 9.9 | 0,001 н AuOH | 0,003 н HBr | MgCl2, K2SO4 |
| 9.10 | 0,09 н Ba(OH)2 | 0,05 н H2SO4 | K2SO4, BaCl2 |
| 9.11 | 0,002 н H2S | 0,0001 н Bi(OH)3 | Ba(NO3)2, K2SO4 |
| 9.12 | 0,001 н H3PO4 | 0,002 н Bi(OH)3 | K2SO4, BaCl2 |
| 9.13 | 0,005 н H2SO4 | 0,003 н Ba(OH)2 | AlCl3, KCl |
| 9.14 | 0,005 н H3AsO3 | 0,003 н H2S | BaCl2, K2SO4 |
| 9.15 | 0,003 н H3AsO3 | 0,005 н H2S | BaCl2, K2SO4 |
| 9.16 | 0,005 н Fe(NO3)2 | 0,008 н KOH | MgCl2, K2SO4 |
| 9.17 | 0,002 н Pb(NO3)2 | 0,001н H2S | MgCl2, CuCl2 |
| 9.18 | 0,005 н CdCl2 | 0,001н H2S | AlCl3, K3PO4 |
| 9.19 | 0,01 н Cd(NO3)2 | 0,03 н H2S | Al(NO3)3, Na2SO4 |
| 9.20 | 0,003 н FeCl3 | 0,001 н NaOH | Al(NO3)3, NiSO4 |
| 9.21 | 0,005 н Fe(NO3)2 | 0,008 н KOH | MgCl2, K2SO4 |
| 0,002 н Pb(NO3)2 | 0,001 н H2S | MgCl2, CuCl2 | |
| 9.23 | 0,001н Pb(NO3)2 | 0,0005 н H2S | Cu(NO3)2, Na2SO4 |
| 9.24 | 0,002 н Pb(NO3)2 | 0,001 н KJ | MgCl2, Na2SO4 |
| 9.25 | 0,001 н Pb(NO3)2 | 0,003 н KJ | BaCl2, Na2SO4 |
