Определение количества реактива
4.2.1. Вычисление стехиометрического количества реактива. Расчет эквивалентного количества реактива, необходимого для осаждения определяемого элемента, основан на стехиометрических соотношениях реагирующих веществ в соответствии с уравнением реакции.
Запишем уравнение реакции осаждения ионов металла Мг+ анионами осадителя А^'"
уМz++ zAy  . (4.3)
. (4.3)
Если известен состав анализируемого вещества (МqХр), то количество реактива BcAd(b) вычисляется по следующей формуле:
 , (4.4)
, (4.4)
Mx, Ma - молекулярные массы реактива BcAd и анализируемого вещества МqХp соответственно; а—навеска образца; у, z, q, d - стехиометрические коэффициенты.
Однако чаще бывает известно лишь приблизительное, содержание М в анализируемом образце (p%). В этом случае расчет производится следующим обaразом.
Находим количество М в образце (С)
С =  (4.5)
(4.5)
Количество реактива (b) определяется по
 , (4.6)
, (4.6)
Ам —атомная масса элемента М; Мх — молекулярная масса реактива BcAd.
Пример 4. Сколько мл 0,5 М раствора H2S04 необходимо взять для осаждения Ва из 0,5 г дигидрата хлорида бария?
Решение. Записываем уравнение реакции
Ва2+ + S042- 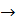 BaS04,
BaS04,
Мв (молекулярная масса ВаСl*2Н20) = 244,27;
Мх (молекулярная масса H2S04) = 98,08.
Вычислим количество H2S04 в г (Ь)
 .
.
Находим объем 0,5 М раствора H2S04 (V)
 .
.
Пример 5. Найти объем раствора H2S04 плотности 1,07, необходимый для осаждения Ва из 0,3 г образца, содержащего около 40% Ва.
Решение. По формуле (4.6) вычисляем стехиометрическое количество Н2S04 в г (Ь)
 .
.
По таблице находим, что концентрация раствора H2S04 плотности 1,07 равна 10,19%. Определяем число мл раствора H2S04 (V)
 .
.
Задачи
486. Сколько 8,4%-ного раствора серной кислоты надо взять для осаждения бария из 0,4859 г дигидрата хлорида бария?
487. Навеска 0,2783 г карбоната бария растворена в хлороводородной кислоте. Сколько 4%-ного раствора серной кислоты надо взять для осаждения бария?
488. Взята навеска 5,0000 г вещества, содержащего около 1% серы, и проведено окисление всей серы в серную кислоту. Сколько 5%-ного раствора хлорида бария потребуется для осаждения образовавшегося сульфат-иона?
489. Сколько 3,3%-ного раствора аммиака надо взять для осаждения гидроксида алюминия из раствора 0,9865 г алюминиево-калиевых квасцов?
490. Сколько 0,1 н раствора щавелевой кислоты надо взять для осаждения кальция из навески гипса 0,2723 г?
491. Сколько 4%-ного раствора гидрофосфата натрия надо взять, чтобы осадить Mg в виде MgNH4P04 из 0,4456 г гептагидрата сульфата магния?
492. Сколько 4,2%-ного раствора нитрата серебра надо взять, чтобы осадить хлорид-ион из 0,1777 г КCl?
493. Сколько 2,8%-ного раствора аммиака надо взять для осаждения железа из навески 0,5263 г руды, содержащей 12% железа?
494. Сколько 4%-ного раствора гидроксида калия надо взять для осаждения оксида меди из раствора 0,7267 г медного купороса?
495. Сколько 10%-ного раствора карбоната натрия надо взять для осаждения цинка в виде карбоната из навески 0,6543 г латуни, содержащей около одной трети цинка?
496. Сколько 7,7%-ного раствора серной кислоты надо взять для осаждения стронция в виде сульфата из навески 0,6327 г безводного хлорида стронция?
497. 1 г серебряного сплава, содержащего около 80% серебра-, растворили в 250 мл. Сколько мл хлороводородной кислоты плотностью 1,020 необходимо взять для осаждения серебра в 25 мл полученного раствора?
498. Сколько 1%-ного раствора диметилглиоксима надо взять для осаждения никеля из навески 0,9531 г сплава, содержащего 0,5% никеля?
499. Сколько 5%-ного раствора оксихинолина надо взять для осаждения алюминия из раствора 0,5173 г сплава, содержащего 3% алюминия?
4.2.2. Вычисление избытка реактива для практически полного осаждения. В гравиметрическом анализе осаждение считается практически полным тогда, когда количество осаждаемой формы в данном объеме раствора не будет превышать 1 *10-4 г.
Во избежание заметных потерь осадка за счет растворимости его как при осаждении, так и последующем промывании вводят некоторый избыток осадителя, определяемый константой растворимости осадка и зависящий от объема раствора.
Допустим, что осаждение ионов Мz+ в виде МуAz проводится в объеме V мл. По условию содержание МуAz в V мл не должно превышать 1 *10-4 г (можно задаться и меньшей величиной).
Найдем концентрацию Mz+([Мz+]) в этом растворе, выраженную в М,
 M,
M,
М0 —молекулярная масса МуAz.
Зная константу растворимости осадка (KS,) вычислим концентрацию ионов осадителя ([Аy-]), которую необходимо иметь в избытке для практически полного осаждения МуAz.
 (4.8)
(4.8)
Общее количество реактива равно сумме эквивалентного количества, вычисляемого по уравнениям (4.4) или (4.6), и избытка его [Аy-], рассчитываемого но уравнению (4.8).
Пример 6. Какой избыток H2S04 необходимо ввести для практически полного осаждения PbS04 из 200 мл раствора?  = 1,6*10-8.
= 1,6*10-8.
Решение. В 200 мл раствора должно содержаться не более 1*10-4 г PbS04 (M0 = 303,3). Концентрация РЬ2+ не должна превышать следующую величину:
[РЬ2+]  1,65*10-6 М .
1,65*10-6 М .
Определим концентрацию SO42-, необходимую для практически полного осаждения,
[SO42- ]  9,6 * 10-3 M.
9,6 * 10-3 M.
Следовательно, избыток H2S04, превышающий эквивалентное количество ее, должен составлять 9,6 * 10-3 М.
Пример 7. Вычислить количество H2SO4 (в г), которое необходимо ввести в промывную жидкость для промывания сульфата стронция с тем, чтобы потеря осадка за счет растворения не превышала 1 * 10-4 г в 300 мл;  =3,2*10-7.
=3,2*10-7.
Решение. Вычислим концентрацию Sr2+ в М (М. м. SrS04=183,68)
[Sr2+]=  10-6 M
10-6 M
Найдем концентрацию S042-
[S042] =[  = 1,78*10-1 М.
= 1,78*10-1 М.
Количество H2S04 в г/л (b) будет равно
b = 1,78*10-1 *98,08 = 17,4 г.
В 300 мл должно содержаться
 .
.
Задачи
500. Какой объем 10,56%-ного раствора серной кислоты надо добавить к 200 мл раствора соли бария, чтобы в нем могло остаться не более 0,00001 г сульфата бария?
501. Сколько 5%-ного раствора хлорида бария надо взять, чтобы при осаждении сульфата бария из 150 мл раствора потеря за счет растворения не превышала 0,00001 г серы?
502. Сколько 4%-ного раствора оксалата аммония надо взять, чтобы в 400 мл фильтрата при осаждении оксалата кальция оставалось не более 0,00001 г оксида кальция?
503. Сколько 2%-ного раствора оксалата аммония надо взять, чтобы в 300 мл фильтрата при осаждении оксалата кальция оставалось не более 0,00001 г кальция?
504. Сколько мл 5%-ного раствора нитрата аммония следует взять, чтобы в 500 мл фильтрата при осаждении MgNH4P04 потеря осадка за счет растворения в пересчете на оксид магния составляла не более 0,0002 г?
505. Какой избыток 7,7%-ного раствора серной кислоты необходим для практически полного осаждения сульфата стронция из 250 мл раствора?
506. Сколько мл 5,5%-ного раствора серной кислоты надо взять, чтобы после осаждения сульфата бария содержание его в 250 мл фильтрата не превышало 0,0001 г?
507. Сколько 10%-ного раствора серной кислоты надо взять для практически полного осаждения стронция из навески 0,6327 г безводного хлорида стронция, растворенного в 250 мл воды?
508. Какова должна быть концентрация раствора нитрата аммония в промывной жидкости для промывания осадка MgNH4P04, чтобы потеря от растворения составляла не более 0,00001 г MgO в 200 мл?
509. Какой общий объем 3%-ного раствора оксалата аммония надо взять для осаждения оксалата кальция из навески карбоната кальция, равной 0,3745 г, чтобы в 300 мл фильтрата оставалось не более 0,00001 г кальция?
510. Сколько г сульфата аммония нужно добавить к 250 мл воды, чтобы при, промывании осадка сульфата бария потеря за счет растворения не превышала 0,001 мг?
511. Сколько г хромата калия нужно добавить к 300 мл воды, чтобы при промывании осадка хромата бария в фильтрат перешло не более 0,003 мг этой соли?
Расчет результатов анализа
4.3.1. Вычисление процентного содержания определяемого вещества. Расчет процентного содержания вещества в анализируемом образце по данным гравиметрического метода основан на точном знании состава весовой формы.
Допустим, требуется определить процентное содержание элемента М в некотором образце. Взята навеска образца, равная а г. Весовая форма имеет состав МnАm, масса ее равна b г. Обозначим через Мв молекулярную массу МnАm, а через Ам— атомную массу элемента М. Найдем количество определяемого элемента в г (х) ос следующей формуле:
 (4.9)
(4.9)
Содержание М в % будет равно
% M  . (4.10)
. (4.10)
Если требуется найти содержание какого-либо соединения элемента в образце (например, MqLp), то расчет может быть проведен так:
% MqLp=  (4.11)
(4.11)
Mq — молекулярная масса MqLp
В некоторых случаях (при большом содержании определяемого вещества) проводят анализ не всей навески, а только некоторой ее части (аликвоты). Для этого после растворения навески переносят раствор в мерную колбу и разбавляют водой до объема V мл, затем берут для анализа пипеткой определенную часть раствора (v мл). Расчет проводится аналогично, с учетом того, что навеска будет, равна
 г.
г.
% M=  . (4.12)
. (4.12)
Пример 8. Найти процентное содержание алюминия в сплаве, если из навески его, равной 0,5618 г, получено 0,1012 г оксида алюминия.
Решение. Молекулярная масса Аl2О3 равна 101,96, атомная масса алюминия —26,98. По формуле (4.9) находим содержание Аl в г (х)
 0,5354 г.
0,5354 г.
Определяем % алюминия в сплаве
% Al 
Пример 9. Вычислить процентное содержание карбоната кальция в известняке по следующим данным. Навеска известняка равна 0,5120 г. После растворения ее, осаждения кальция в виде оксалата и прокаливания осадка получено 0,2160 г оксида кальция.
Решение. Процентное, содержание СаС03 можно вычислить по формуле (4.11). В данном случае МСа0 = 56,08; МСаСОз = 100,09: n = 1; q = 1.
% СаС03 
Задачи
Рассчитать процентное содержание
512. Бария в барите, если навеска его 0,3115 г. В результате анализа получено 0,2318 г сульфата бария.
513. Алюминия в криолите, если навеска его 0,6118 г. В результате анализа получено 0,1502 г оксида алюминия.
51.4. СаС03 в доломите, если навеска его 1,0000 г. В результате анализа получено 0,3515 г оксида кальция.
515. Карбоната магния в доломите, если навеска его 0,5000 г. В результате анализа получено 0,2856 г дифосфата .магния.
516. Серы в чугуне, если навеска его 13,7400 г. В результате Анализа получено 0,1086 г сульфата бария.
517. Серы в каменном угле, если навеска его 2,9440 г.В результате анализа получено 0,1526 г сульфата бария.
518. Магния в сплаве, если навеска его 4,3700 г. В результате анализа получено 0,1323 г дифосфата магния.
519. Серной кислоты в растворе (объемные проценты), если для анализа было взято 10 мл этой кислоты и разбавлено в мерной колбе до 100 мл. При осаждении сульфат-иона хлоридом бария из 10 мл разбавленного раствора было получено 0,2377 г сульфата бария.
520. Полуторных оксидов (R203) в силикате, если навеска его 0,5692 г. Фильтрат после отделения кремниевой кислоты разбавлен в мерной колбе до 250 мл. При осаждении гидроксидов из 150 мл этого раствора получено 0,0688 г полуторных оксидов.
521. Оксида кальция в силикате, если навеска его 0,5692 г. Фильтрат после отделения кремниевой кислоты и полуторных оксидов (Fe203 + Al203) доведен в мерной колбе до 250 мл. После осаждения кальция оксалатом из 150 мл этого раствора было получено 0,0725 г оксида кальция.
522. Фосфора в чугуне, если навеска его 10,8160 г. j В результате анализа получено 0,1218 г дифосфата магния.
523. Магния в сплаве, если для анализа бы.ла взята навеска 5,2160 г. После растворения сплава раствор доведен в мерной колбе-до 250 мл. Магний определялся из ?0 мл этого раствора и в результате анализа было получено 0,1218 г дифосфата магния.
524. Марганца в сплаве, если для анализа была взята навеска 10,1800 г. После растворения сплава раствор был доведен в мерной колбе до 250 мл. Марганец определялся из 50 мл этого раствора и в результате анализа было получено 0,1628 г дифосфата марганца.
525. Цинка в сплаве, если навеска его 5,8160 г. После растворения сплава раствор доведен в мерной колбе до 250 мл. Для определения цинка взято 100 мл этого раствора, и в результате анализа получено 0,1125 г дифосфата цинка.
526. Серебра в сплаве, если навеска, его 0,5868 г. В результате анализа получено 0,1556 г хлорида серебра.
527. Si02, полуторных оксидов (Аl2O3 + Fe203), СаО и MgO в силикате, если навеска его 0,5686 г. В результате анализа получено: Si02 — 0,3184 г, полуторных оксидов — 0,1192 г, СаО — 0.0856 г, Mg2P207— 0,1104 г.
528. Карбонатов кальция и магния в известняке, если навеска его 0,9866 г. В результате анализа получено оксида кальция 0,3755 г и дифосфата магния 0,4105 г.
529. Железа в красном железняке, если навеска его 0.6114 г. В результате анализа было
4.3.2. Вычисление аналитических множителей. При серийных анализах для ускорения расчетов часто используют так называемый аналитический множитель, или фактор пересчета (F). Эта величина входит в качестве постоянного множителя в уравнения (4.10) и (4.11)
F=  -. (4.13)
-. (4.13)
Для однотипных расчетов уравнение (4.10) можно преобразовать следующим образом:
 (4.14)
(4.14)
Пример 10. Вычислить аналитический множитель при определении магния в виде Mg2P207.
Решение. В данном случае Ам= 24,31; Мв = 222,55; n = 2.
F =  0,5885.
0,5885.
Задачи
