Основные типы взаимодействия в-ва с излучением:
Люминесцентный анализоснован на исследовании излучения флуоресценции и фосфоресценции главным образом твердых и жидких проб при воздействии на них ультрафиолетового или корпускулярного излучения. Особенно широкое распространение получил анализ на основе наблюдения фотофлуоресценции. В этом случае проба освещается ультрафиолетовым излучением ртутной лампы через черное увиолевое стекло; этот фильтр пропускает невидимое излучение яркой ртутной линии 3650А и других близлежащих линий и устраняет видимый свет лампы. Под действием ультрафиолетовых лучей проба или ее отдельные части (в случае неоднородных проб, например, минералов, порошков) начинают светиться характерным светом. Цвет этого свечения и его интенсивность являются аналитическими признаками, позволяющими производить качественный и количественный анализы. В ряде случаев применяется спектральное разложение свечения флуоресценции; суждение о составе и концентрации делается на основе изучения спектрального состава излучения.
Явление флуоресценции характеризуется следующими свойствами, определяющими его аналитические возможности. Под действием коротковолнового излучения возбуждаются электронные оболочки люминесцентных молекул, присутствующих в веществе пробы - необходимо, чтобы возбуждающее излучение находилось внутри полосы поглощения исследуемых молекул. Возбужденные молекулы начинают излучать свет, максимум спектра которого сдвинут в сторону длинных волн по отношению к максимуму спектра поглощения; вследствие этого обычно длины волн спектра люминесценции больше, чем длина волны возбуждающего света.Однако часть энергии, поглощенная молекулами вещества, при некоторых условиях может до излучения распределиться по другим степеням свободы молекул, при этом происходит тушение флуоресценции - оно связано как со свойствами самого люминесцентного вещества, так и со свойствами растворителя и особенно сильно развивается при больших концентрациях люминесцентного вещества в растворе (концентрационноетушение).
Люминесцентный анализпо спектрам флуоресценции обладает исключительно высокой чувствительностью: например, атомы урана обнаруживаются в ничтожных концентрациях до 10-8— 10-6 %, в то время как эмиссионный элементный анализ обнаруживает только 10-4 —10-3 %. Однако столь высокая чувствительность люминесцентного анализа приводит к серьезным трудностям: достаточно незначительной примеси постороннего вещества, также способного люминесцировать, чтобы его свечение обнаруживалось в наблюдаемом спектре и искажало результаты визуального определения, когда анализ проводится без спектрального разложения.
Люминесцентный анализ находит широкое применение в пищевой промышленности (контроль свежести продуктов), в сельском хозяйстве (контроль всхожести семян), в биологии и медицине (различение здоровых тканей от больных, обнаружение бактерий), в заводских лабораториях (для обнаружения пороков и трещин в металлических деталях) и т. п. Большое преимущество такого метода анализа в его простоте, быстроте и несложности применяемой аппаратуры, особенно для случая качественного анализа.
Атомная спектроскопия— исследование энергетических переходов между состояниями электронов на атомных орбиталях.
Абсорбционная спектроскопия—метод изучения энергетических состояний квантовых систем путём исследования спектров поглощения электромагнитного излучения. В абсорбционной спектроскопии используют излучение непрерывного спектра. Через слой исследуемого вещества пропускают излучение непрерывного спектра, часть которого поглощается. Поглощаются волны с длинами, характерными для энергетических состояний исследуемого вещества. Применяется для определения концентрации веществ в растворах. Обладает рядом ценных качеств: возможность одновременного получения качественных и количественных данных, большая информация о химической природе вещества, высокая скорость анализа, высокая чувствительность метода, возможность анализа веществ во всех агрегатных состояниях, возможность анализа смесей без их разделения на компоненты, возможность многократного использования пробы для повторного исследования, позволяет исследовать микроскопические объекты, возможность применения ЭВМ для обработки данных);
Атомно-эмиссионная спектроскопия (спектрометрия), АЭС — совокупность методов элементного анализа, основанных на изучении спектров испускания свободных атомов и ионов в газовой фазе. Обычно эмиссионные спектрырегистрируют в наиболее удобной оптической области длин волн от ~200 до ~1000 нм (для регистрации спектров в области <200 нм требуется применение вакуумной спектроскопии, чтобы избавиться от поглощения коротковолнового излучения воздухом. Для регистрации спектров в области >1000 нм требуются специальные инфракрасные или микроволновые детекторы.)
АЭС — способ определения элементного состава вещества по оптическим линейчатым спектрам излучения атомов и ионов анализируемой пробы. В качестве источников света для атомно-эмиссионного анализа используют пламя горелки или различные виды плазмы, включая плазму электрической искры или дуги, плазму лазерной искры, индуктивно-связанную плазму, тлеющий разряд и др.
Важным достоинством АЭС по сравнению с другими оптическими спектральными являются возможности бесконтактного, экспрессного, одновременного количественного определения большого числа элементов в широком интервале концентраций с приемлемой точностью при использовании малой массы пробы.
Процесс атомно-эмиссионного спектрального анализа состоит из следующих основных звеньев:
1. Пробоподготовка (подготовка образца)
2. Испарениеанализируемой пробы (если она не газообразная);
3. Диссоциация— атомизация её молекул;
4. Возбуждение излучения атомов и ионов элементов пробы;
5. Разложение возбужденного излучения в спектр;
6. Регистрация спектра;
7. Идентификация спектральных линий — с целью установления элементного состава пробы (качественный анализ);
8. Измерение интенсивности аналитических линий элементов пробы, подлежащих количественному определению;
9. Нахождение количественного содержания элементов с помощью установленных предварительно градуировочных зависимостей.
Молекулярная спектроскопия — исследование энергетических переходов между электронными, колебательными и вращательными уровнями энергии молекул.
Фотоэлектронная спектроскопия — метод изучения строения вещества, основанный на измерении энергетических спектров электронов, вылетающих при фотоэлектронной эмиссии.Согласно второму закону фотоэффекта, сумма энергии связи вылетающего электрона (работы выхода) и его кинетической энергии равна энергии падающего фотона hν (h — постоянная Планка, ν — частота падающего излучения). По спектру электронов можно определить энергии связи электронов и их уровни энергии в исследуемом веществе. В фотоэлектронной спектроскопии применяются монохроматическое рентгеновское или ультрафиолетовое излучения. Спектр фотоэлектронов исследуют при помощи электронных спектрометров высокого разрешения. Метод фотоэлектронной спектроскопии применим к веществу в газообразном, жидком и твёрдом состояниях, и позволяет исследовать как внешние, так и внутренние электронные оболочки атомов и молекул, уровни энергии электронов в твёрдом теле (в частности, распределение электронов в зоне проводимости). Для молекул энергии связи электронов во внутренних оболочках образующих их атомов зависят от типа химической связи (химические сдвиги), поэтому фотоэлектронная спектроскопия успешно применяется в аналитической химии для определения состава вещества и в физической для исследования химической связи. В химии метод фотоэлектронной спектроскопии известен под название ЭСХА — электронная спектроскопия для химического анализа.
Оптическая спектроскопия — спектроскопия в оптическом (видимом) диапазоне длин волн с примыкающими к нему ультрафиолетовым и инфракрасным диапазонами (от нескольких сотен нанометров до единиц микрон). Этим методом получено подавляющее большинство информации о том, как устроено вещество на атомном и молекулярном уровне, как атомы и молекулы ведут себя при объединении в конденсированные вещества. Особенность оптической спектроскопии по сравнению с другими видами спектроскопии состоит в том, что большинство структурно организованной материи (крупнее атомов) резонансно взаимодействует с электромагнитным полем именно в оптическом диапазоне частот. Поэтому именно оптическая спектроскопия используется в настоящее время очень широко для получения информации о веществе;
Инфракрасная спектроскопия — раздел спектроскопии, изучающий взаимодействие инфракрасного излучения с веществами.
При пропускании инфракрасного излучения через вещество происходит возбуждение колебательных движений молекул или их отдельных фрагментов. При этом наблюдается ослабление интенсивности света, прошедшего через образец. Однако поглощение происходит не во всём спектре падающего излучения, а лишь при тех длинах волн, энергия которых соответствует энергиям возбуждения колебаний в изучаемых молекулах. Следовательно, длины волн (или частоты), при которых наблюдается максимальное поглощение ИК-излучения, могут свидетельствовать о наличии в молекулах образца тех или иных функциональных групп и других фрагментов, что широко используется в различных областях химии для установления структуры соединений.
Экспериментальным результатом в ИК-спектроскопии является инфракрасный спектр — функция интенсивности пропущенного инфракрасного излучения от его частоты. Обычно инфракрасный спектр содержит ряд полос поглощения, по положению и относительной интенсивности которых делается вывод о строении изучаемого образца. Такой подход стал возможен благодаря большому количеству накопленной экспериментальной информации: существуют специальные таблицы, связывающие частоты поглощения с наличием в образце определённых молекулярных фрагментов. Созданы также базы ИК-спектров некоторых классов соединений, которые позволяют автоматически сравнивать спектр неизвестного анализируемого вещества с уже известными и таким образом идентифицировать это вещество.
Инфракрасная спектроскопия является ценным аналитическим методом и служит для исследования строения органических молекул, неорганических и координационных, а также высокомолекулярных соединений. Основным прибором, используемым для подобных анализов, является инфракрасный спектрометр.
Ультрафиолетовая (электронная) спектроскопия — раздел оптической спектроскопии, который включает получение, исследование и применение спектров испускания, поглощения и отражения в ультрафиолетовой области.Энергия фотонов ультрафиолетового и видимого диапазонов спектра достаточно высока (1,7—100 эВ или примерно от 100 до 730 нм), чтобы перевести электроны органических молекул из основного состояния в возбужденное. Разность энергий между этими состояниями квантована, поэтому молекулы поглощают фотоны только строго определенной энергии.
В УФ-области поглощают все органические вещества. Как правило, «рабочая» область составляет интервал 190—730 нм, главным образом от 200 до 380 нм. В этих областях прозрачны оптические материалы для изготовления призм и кювет. Длины волн менее 190 нм (вакуумный ультрафиолет) менее удобен для работы, так как в этой области поглощают компоненты воздуха — кислород и азот. Поэтому для работы здесь используются специальные вакуумные камеры, что усложняет лабораторную практику, однако часто бывает незаменимым.
Необходимые для исследования количества вещества невелики — около 0,1 мг. В связи с этим УФ-спектроскопия является одним из наиболее распространенных физико-химических методов исследования органических и неорганических соединений;
Рентгеноспектральный анализ — инструментальный метод элементного анализа, основанный на изучении спектра рентгеновских лучей, прошедших сквозь образец или испущенных им. При облучении у атома удаляются электроны из внутренних оболочек. Электроны из внешних оболочек перескакивают на вакантные места, высвобождая избыточную энергию в виде кванта рентгеновского диапазона или передавая её другому электрону из внешних оболочек. По энергиям и количеству испущенных квантов судят о количественном и качественном составе анализируемого вещества.
В качестве источников возбуждения применяют рентгеновское излучение или электронный пучок. Результаты анализа могут быть качественными или количественными.
Микроволновая спектроскопия — методика определения геометрического строения молекул по микроволновым спектрам, обусловленным переходами между вращательными энергетическими уровнями.
Определение таких параметров молекул, как дипольный момент и моменты инерции относительно главных осей методом микроволновой спектроскопии производится в подавляющем большинстве случаев путём анализа спектров поглощения электромагнитного излучения в диапазоне 10–40 ГГц, обусловленных переходами молекулы с одного вращательного энергетического уровня на другой.
Метод микроволновой спектроскопии является очень точным для сравнительно простых молекул, но с ростом молекулярной массы на точность метода начинает влиять колебательно-вращательное взаимодействие. С помощью этого метода были определены с высокой точностью геометрические параметры многих двух-, трех- и четырехатомных молекул, а также был исследован такой интересный эффект, как инверсия. Метод плохо применим для неполярных молекул и используется для исследования веществ только в газовой фазе;
Метод ядерного гамма-резонанса (Мёссбауэровская спектроскопия) основан на эффекте Мёссбауэра, который заключается в резонансномпоглощении без отдачи атомным ядром монохроматического γ-излучения, испускаемого радиоактивным источником. В абсорбционной мёссбауэровской спектроскопии (наиболее часто применяемой разновидности метода) образец-поглотитель просвечивается гамма-квантами, излучаемыми возбуждённым железом-57 (57Fe), иридием-191 (191Ir) или другим мёссбауэровским изотопом. За поглотителем располагается детектор, с помощью которого измеряется коэффициент поглощения γ-квантов образцом. Образец должен содержать такие же ядра (57Fe, 191Ir и т. д.). Возбуждённые ядра в источнике создаются при распаде соответствующего радиоактивного изотопа (например, 57Co, превращающийся в возбуждённое состояние 57Fe). В обычных условиях ядро, излучающее гамма-квант, приобретает импульс отдачи (что приводит к некоторому уменьшению энергии γ-кванта); поглощающее ядро, захватив гамма-квант, также приобретает импульс отдачи. Импульс отдачи ядра воспринимается кристаллической решеткой образца и источника (т.е. макроскопическими объектами), в результате доплеровский сдвиггамма-линий становится пренебрежимо малым (значительно меньшим, чем естественная ширина гамма-линии). Благодаря этому обстоятельству, небольшое изменение относительной скорости источника и поглотителя (порядка см/с) позволяет сканировать тонкую структуру уровней ядра, которая зависит от его химического окружения. Зависимость коэффициента поглощения образца от относительной скорости движения источника и образца (т.е. от энергии поглощаемого гамма-кванта) называется мёссбауэровским спектром поглощения. Этот спектр позволяет судить об электронной структуре атома в исследуемом веществе, окружающих группах и о характере их взаимодействий.
Масс-спектрометрия — метод исследованиявещества, основанный на определении отношения массы к заряду ионов, образующихся при ионизации представляющих интерес компонентов пробы. Можно сказать, что масс-спектрометрия — это «взвешивание» молекул, находящихся в пробе.Окончание «-метрия» в названии метода появилось после повсеместного перехода от детектирования заряженных частиц при помощи фотопластинок к электрическим измерениям ионных токов. Особенно широкое применение масс-спектрометрия находит в анализе органических веществ, поскольку обеспечивает уверенную идентификацию как относительно простых, так и сложных молекул. Единственное общее требование — чтобы молекула поддавалась ионизации. Однако к настоящему времени придумано столько способов ионизации компонентов пробы, что масс-спектрометрию можно считать практически всеохватным методом. Почти все масс-спектрометры — это вакуумные приборы, поскольку ионы очень нестабильны в присутствии посторонних молекул.
Масс-спектр — это зависимость интенсивности ионного тока (количества вещества) от отношения массы к заряду (природы вещества). Поскольку масса любой молекулы складывается из масс составляющих её атомов, масс-спектр всегда дискретен, хотя при низком разрешении масс-спектрометра пики разных масс могут перекрываться или даже сливаться. Природа анализируемого вещества, особенности метода ионизации и вторичные процессы в масс-спектрометре могут влиять на масс-спектр. Так, ионы с одинаковыми отношениями массы к заряду могут оказаться в разных частях спектра и даже сделать часть его непрерывным.Точное определение массы анализируемой молекулы позволяет определить её элементный состав.
Ядерный магнитный резонанс (ЯМР) — резонансное поглощение или излучение электромагнитной энергии веществомна частоте ν (называемой частотой ЯМР), обусловленное переориентацией магнитных моментов ядер.
Одни и те же ядра атомов в различных окружениях в молекуле показывают различные сигналы ЯМР. Отличие такого сигнала ЯМР от сигнала стандартного вещества позволяет определить так называемый химический сдвиг, который обусловлен химическим строением изучаемого вещества. В методиках ЯМР есть много возможностей определять химическое строение веществ, конформации молекул, эффекты взаимного влияния, внутримолекулярные превращения.
Электронный парамагнитный резонанс (ЭПР) — суть явления электронного парамагнитного резонанса заключается в резонансном поглощении электромагнитного излучения неспаренными электронами. Электрон имеет спин {\displaystyle S=1/2}(наличие спина просто означает, что частица кроме массы покоя имеет момент собственного вращения – для электрона это означает, что если его представить в виде шарика, то он ДОЛЖЕН вращаться вокруг собственной оси и потому создает магнитное поле) и ассоциированный с ним магнитный момент.
Классификация спектрометрических методов по характеру процесса: (очень «корректная» формулировка вопроса, мысленно шлите их куда подальше и рассказывайте про результат вышеперечисленных процессов)
1) качественный,когда в результате анализа определяется состав без указания на количественное соотношение компонентов или дается оценка — много, мало, очень мало, следы;
2) полуколичественный или приближенный. В этом случае результат выдается в виде оценки со держания компонентов в некоторых более или менее узких интервалах концентраций в зависимости от применяемого метода приближенной количественной оценки. Этот метод благодаря его быстроте нашел широкое применение при решении задач, не требующих точного количественного определения, например, присортировке металла, при оценке содержания геологических проб при поисках полезных ископаемых;
3) количественный,при котором выдается точное количественное содержание определяемых элементов или соединений в пробе.
44) Спектроскопические методы анализа. Спектры молекул; их особенности. Схемы электронных уровней молекулы. Электронные, колебательные и вращательные спектры молекул. Зависимость вида спектра от агрегатного состояния в-ва.
Молекулярные спектры– это спектры испускания, поглощения или комбинационного рассеяния электромагнитного излучения свободными или слабо связанными молекулами. Они имеют вид совокупности полос (редко линий) в УФ, видимой, инфракрасной и радиоволновой областях спектра. Положение полос в спектрах испускания (эмиссионных молекулярных спектрах) и поглощения (абсорбционных молекулярных спектрах) характеризуется частотами n, длинами волн l (типо это лямбда) = c/n или волновыми числами v=1/l, как правило в их максимуме, и определяется разностью энергий Екон. и Енач., между которыми происходит переход hl= Екон - Екач.
Состояние молекулярных систем, переходы между которыми проявляются в виде тех или иных молекулярных спектров, имеют разную природу и сильно различаются по энергиям. Уровни энергии некоторых видов расположены далеко друг от друга, так что при переходах молекула поглощает или испускает высокочастотное излучение. Расстояние между энергетическими уровнями другой природы отнюдь не велико, а в некоторых случаях, в отсутствие внешнего поля, уровни сливаются (вырождаются). При малых разностях энергий переходы наблюдаются в низкочастотной области. Например, ядра атомов некоторых элементов и неспаренные электроны обладают собственным магнитным моментом. В отсутствие внешнего магнитного поля, ориентации магнитных моментов этих частиц произвольны, т.е. они не квантуются, и соответствующие энергетические состояния вырождены. При наложении внешнего постоянного магнитного поля вырождение снимается и появляется возможность перехода между уровнями энергии, наблюдаемыми в радиочастотной области спектра. Так возникают спектры ЯМР и ЭПР.
Традиционно к собственно молекулярным спектрам относятся только спектры, связанные с оптическими переходами между электроноколебательно вращательными уровнями энергии молекулы, связанными с тремя основными типами энергетических уровней молекулы - электронными Еэл.,колебательными Екол. и вращательными Евр., соответствующими трем типам внутреннего движения в молекуле:
Емол = Еэл. + Екол. +Евр
За Еэл принимают энергию равновесной конфигурации молекулы в данном электронном состоянии. Набор возможных электронных состояний молекулы определяется свойствами ее электронной оболочки и симметрией. Колебательные движения ядер в молекуле относительно их равновесного положения в каждом электронном состоянии квантуются так, что образуется сложная система колебательных уровней энергии Екол. Вращение молекулы как целого, как жесткой системы связанных атомов, характеризуется вращательным моментом количества движения, который квантуется, образуя вращательные уровни энергии Евр. При этом Еэл. > Екол. >Евр.
Обычно энергия электронных переходов имеет величину 105-107 Дж/молъ (несколько эВ), колебательных 103-105 Дж/моль. (10-2-10-1 эВ), вращательных 10-103 Дж/моль (10-5 – 10-3 эВ). Cxeма энергетических уровней молекулы представлена на рис.1.
Т.о., у молекулы не может быть чисто электронных переходов, а возможны только электронно-колебательно-вращательные (ЭКВ) переходы. Очевидно, что число ЭКВ-переходов у молекулы заведомо больше, чем электронных переходом у атомов. Поэтому спектры молекул как правило сложнее и состоят из большего числа спектральных линий, которые благодаря близости своих характеристик чаще всего сливаются в спектральные полосы различной ширины.
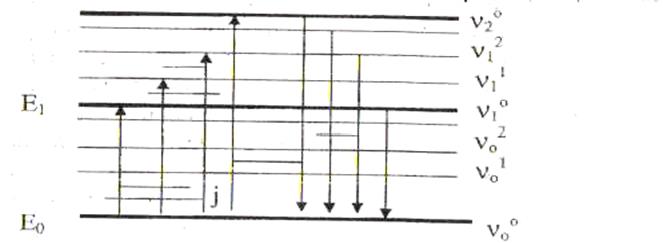
Рис 1. Схема энергетических уровней молекулы:Е0, Е1, - электронные энергетические уровни молекулы;n00(ню – обозначение слева на рис.1) - колебательные уровни молекулы в невозбужденном состоянии;n01 – колебательные уровни молекулы в возбужденном состоянии;J - вращательные уровни молекулы
Если на молекулу анализируемого вещества воздействует излучение УФ и видимого диапазона, то в молекуле могут происходить ЭКВ-переходы типа «а», «б» (рис. 2 внизу). При этом ЭКВ—переходы типа «а» соответствуют поглощению УФ и видимого диапазона. Они изучаются электронной спектроскопией поглощения УФ- и видимого диапазона, лежащей и основе фото- и спектрофотометрического анализа.ЭКВ-переходы типа «б» соответствуют испусканию излучения этого же диапазона и лежат в основе явления люминесценции и основанного на нем флуоресцентного анализа.
Если молекула анализируемого вещества взаимодействует с ИК-излучением, его поглощение приводит к изменению колебательного состояния молекулы в пределах основного электронного состояния.
Энергии микроволнового излучения достаточно лишь для измерения вращательной энергии молекулы в невозбужденном электронном состоянии.
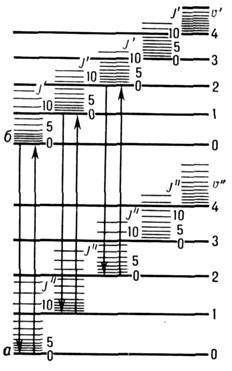
Рис. 2. Схема уровней энергии двухатомной молекулы: aиб-электронные уровни;u'и u''- колебательные квантовые числа;J'иJ'' - вращательные квантовые числа.
В соответствии с тремя системами уровней энергии в молекуле - электронной, колебательной и вращательной - молекулярные спектры состоят из совокупности электронных, колебат. и вращат. спектрови лежат в широком диапазоне электромагнитных волн - от радиочастот до рентг. области спектра. Частоты переходов между вращат. уровнями энергии обычно попадают в микроволновую область (в шкале волновых чисел 0,03-30 см-1), частоты переходов между колебат. уровнями в ИК-область (400-10 000 см-1), а частоты переходов между электронными уровнями - в видимую и УФ-области спектра. Это разделение условное, т. к. часто вращат. переходы попадают и в ИК-область, колебат. переходы - в видимую область, а электронные переходы - в ИК-область. Обычно электронные переходы сопровождаются и изменением колебат. энергии молекулы, а при колебат. переходах изменяется и вращат. энергия. Поэтому чаще всего электронный спектр представляет собой системы электронно-колебат. полос, причём при высоком разрешении спектральной аппаратуры обнаруживается их вращат. структура. Интенсивность линий и полос в молекулярных спектрах определяется вероятностью соответствующего квантового перехода.
Электронные спектры: чисто электронные молекулярные спектры возникают при изменении электронной энергии молекул, если при этом не меняются колебат. и вращат. энергии. Электронные молекулярные спектры наблюдаются как в поглощении (спектры поглощения), так и в испускании (спектры люминесценции). При электронных переходах обычно изменяется электрич. дипольный момент молекулы (векторная физическая величина, характеризующая, наряду с суммарным зарядом, электрические свойства системы заряженных частиц (распределения зарядов) в смысле создаваемого ею поля и действия на неё внешних полей).B спектрах поглощения обычно наблюдают переходы из основного электронного состояния в возбуждённые электронные состояния.
Колебательные спектры наблюдаются при изменении колебат. энергии (электронная и вращат. энергии при этом не должны меняться). Осн. колебат. полосы линейной многоатомной молекулы, соответствующие переходам из осн. колебат. состояния, могут быть двух типов: параллельные (||) полосы, соответствующие переходам с дипольным моментом перехода, направленным по оси молекулы, и перпендикулярные полосы, отвечающие переходам с дипольным моментом перехода, перпендикулярным оси молекулы.
Вращательные спектры:молекулярные спектры, обусловленные квантовыми переходами между дискретными вращательными энергетическими состояниями молекул. Наряду с колебательными спектрами и электронными спектрами возникают в результате взаимод. молекул с электромагн. излучением. Вращательные спектры экспериментально наблюдаются для достаточно легких молекул в-в в газовой фазе в длинноволновом ИК и микроволновом диапазонах.Применимы только в газовой фазе, где можно отличить переходы между отдельными квантовыми состояниями, известными как вращательные уровни энергии. Молекулярные вращательные движения быстро затухают и превращается в другие виды энергии в твердых телах и жидкостях. Вращательные спектры можно наблюдать для молекул, которые имеют постоянный электрический дипольный момент.
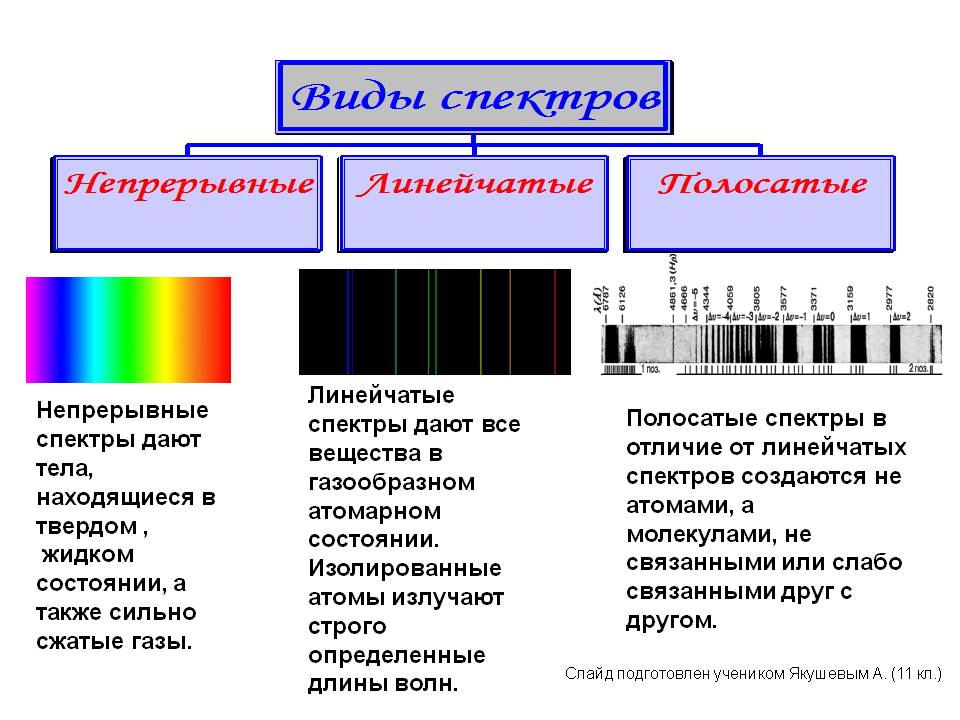
Зависимость вида спектра от агрегатного состояния вещества: характер спектра зависит, в основном, от агрегатного состояния вещества. Для твердых и жидких тел, как правило, характерны непрерывные спектры излучения, а для газообразных — линейчатые, которые при больших давлениях или больших толщинах чаще переходят в непрерывный.
Атомы газов находятся далеко друг от друга, поэтому энергетически почти не взаимодействуют, т. е. излучаемая энергия атомов не изменяется за счет взаимодействия атомов. Спектр мы будем иметь линейчатый. Спектр поглощения тоже линейчатый.
45) Спектроскопические методы анализа. Основные законы испускания и поглощения электромагнитного излучения. Связь аналитического сигнала с концентрацией определяемого компонента. Основные способы определения концентраций в спектроскопических методах.
Испускание (или поглощение) электромагнитного излучения происходит при переходе атома из одного стационарного состояния в другое. При этом испускается (или поглощается) фотон монохроматического излучения с энергией, равной разности энергий энергетических уровней Еm и En:hn = Em - En,
где Em и En - энергия системы в первом и втором состояниях, h – постоянная Планка, n - частота излучаемой волны.
Рассмотрим однородный поглощающий объект, например, раствор поглощающего вещества, перпендикулярно поверхности которого направляется поток монохроматического излучения с интенсивностью I0. При прохождении через слой раствора с толщиной 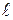 ,интенсивность электромагнитного излучения уменьшается и становится равной I.
,интенсивность электромагнитного излучения уменьшается и становится равной I.
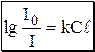
Данное уравнение является математическим выражением основного закона светопоглощения (закона Бугера-Ламберта-Бера, закона Бугера).Количество электромагнитного излучения, поглощённого раствором, прямо пропорционально концентрации поглощающих частиц и толщине слоя. Отношение I/I0 называется пропусканием и обозначается T. Десятичный логарифм величины обратной пропусканию называется оптической плотностью (или светопоглощением) и обозначается A, или, в старой литературе, D.
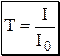
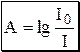
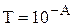
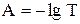
Коэффициент k в математическом выражении закона Бугера-Ламберта-Бера называется коэффициентом поглощения.
При количественном измерении определяют интенсивность аналитического сигнала, т.е. числовое значение свойства, связанного с количественным содержанием анализируемого компонента. По результатам количественного измерения с помощью уравнения связи рассчитывают содержание определяемого компонента в пробе. Уравнение связи выражает количественную зависимость между интенсивностью аналитического сигнала (измеряемой величиной) и количеством или содержанием анализируемого компонента
Р = f(с),
где Р – интенсивность аналитического сигнала; с – концентрация вещества.
Для определения концентрации анализируемого вещества наиболее часто используют следующие методы: 1) молярного коэффициента светопоглощения; 2) градуировочного графика; 3) добавок; 4) дифференциальной фотометрии; 5) фотометрического титрования.
Метод молярного коэффициента поглощения: при работе по этому методу определяют оптическую плотность нескольких стандартных растворов Аст, для каждого раствора рассчитывают e = Аст / (lсст) и полученное значение усредняют. Затем измеряют оптическую плотность анализируемого раствора Ах и рассчитывают концентрацию сх по формуле: сх = Ах /(el). Ограничением метода является обязательное подчинение анализируемой системы закону Бугера-Ламберта-Бера, по крайней мере, в области исследуемых концентраций.
Метод градуировочного графика: готовят серию разведений стандартного раствора, измеряют их поглощение, строят график в координатах Аст – Сст. Затем измеряют поглощение анализируемого раствора и по графику определяют его концентрацию.
Метод добавок: этот метод применяют при анализе растворов сложного состава, так как он позволяет автоматически учесть влияние «третьих» компонентов. Сущность его заключается в следующем: сначала определяют оптическую плотность Ах анализируемого раствора, содержащего определяемый компонент неизвестной концентрации сх, а затем в анализируемый раствор добавляют известное количество определяемого компонента (сст) и вновь измеряют оптическую плотность Ах+ст.
Оптическая плотность Ах анализируемого раствора равнаАх = e l cх,а оптическая плотность анализируемого раствора с добавкой стандартногоАх+ст = e l (cх + сст).Концентрацию анализируемого раствора находим по формуле:сх = сст Ах / (Ах+ст – Ах).
Метод дифференциальной фотометрии: если в обычной фотометрии сравнивается интенсивность света, прошедшего через анализируемый раствор неизвестной концентрации, с интенсивностью света, прошедшего через растворитель, то в дифференциальной фотометрии второй луч света проходит не через растворитель, а через окрашенный раствор известной концентрации – так называемый раствор сравнения.
Фотометрическим методом можно определять также компоненты смеси двух и более веществ. Эти определения основаны на свойстве аддитивности оптической плотности:Асм = А1 + А2 + …+ Аn, где Асм - оптическая плотность смеси; А1 , А2, Аn – оптические плотности для различных компонентов смеси.
Фотометрические методы анализа применяются для контроля разнообразных производственных процессов. Эти методы могут быть применены для анализа больших и малых содержаний, но особенно ценной их особенностью является возможность определения примесей (до 10-5...10-6%). Методы абсорбционной спектроскопии используют в химической, металлургической, фармацевтической и других отраслях, а также в медицине и сельскохозяйственном производстве.
46) Молекулярная абсорбционная спектроскопия (спектрофотометрия). Связь химической структуры соединения с абсорбционным спектром. Способы получения окрашенных соединений. Фотометрические аналитические реагенты, требования к ним. Способы определения концентраций веществ. Измерение высоких, низких оптических плотностей (диф
