Показатель кислотности (рН), возможно, самый важный параметр, который влияет на степень гидролиза лекарственного препарата в жидком состоянии
Если степень гидролиза препарата в виде серии буферных растворов определенного (требуемого) рН является измеримой величиной, то константа гидролиза – это построенная графическая зависимость функции от рН, эту зависимость рН-гидролиз можно вычислить, но она будет практически полностью зависеть от буфера, использующегося для приготовления растворов.
Вполне вероятно, что разную зависимость характеристики рН-гидролиз можно было бы получить, используя различные буферные системы. Чтобы понять, почему так происходит, нам необходимо учесть не только каталитический эффект ионов водорода и гидроксила, который называется специфическим кислотно-основным катализом, но и возможное ускоряющее влияние компонентов буферной системы, которое мы назовем как основной кислотно-основный катализ. Эти 2 типа кислотно-основного катализа можно объединить и выразить в виде:
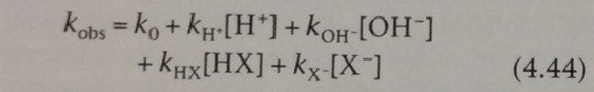
В данном выражении kobs – это экспериментально определенная константа скорости гидролиза, k0 – это некатализируемая или катализируемая константа скорости растворения, kH и kOH – это конкретные кислотно- и основно-катализируемые константы скорости соответсовенно, kНХ и kх – это общие кислотно- и основно-катализируемые константы скорости соответственно и [HX] и [X-] означают концентрацию протонированной и непротонированной форм буферной системы.
Для полноценного определения стабильности лекарственного препарата нам необходимо оценить каталитические коэффициенты для конкретных ускоряемых кислот и оснований, а также определить коэффициенты ускорения потенциальных буферных систем, которые мы хотели бы по возможности использовать в рецептуре.
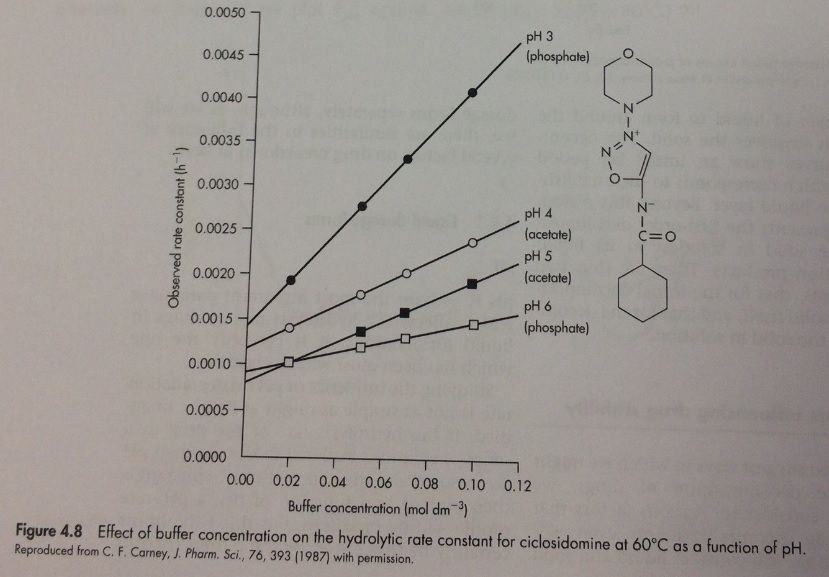
Во-первых, мы разберемся, как добиться независимости характеристики рН-скорость гидролиза от буфера, поскольку это даст нам значение pH, при котором стабильность лекарственного средства наибольшая. С помощью графика мы можем рассмотреть отдельный пример изучения стабильности, описанной для антигипертензивного вазодилататора Циклозидомина.
Чтобы устранить влияние буфера, скорость реакции должна быть измерена в серии концентраций буфера при каждом значении рН и данные экстраполированы обратно к нулевой концентрации, как показано на рис.4.8. Если эти экстраполируемые константы скорости построены в зависимости от рН, требуемый буфер-независимый рН-показатель будет получен.
Эксперименты проводятся при постоянной температуре и постоянной ионной силе, используя серию разных буферных растворов в диапазоне рН 3-6, изображенных на графике 4.8. Он показывает, что увеличение концентрации буфера, особенно при рН 3, приводит к снижению скорости гидролиза. Этот эффект фосфатной буферной системы становится менее выраженным с увеличением рН, а также был обнаружен незначительный эффект при рН около 7,5.
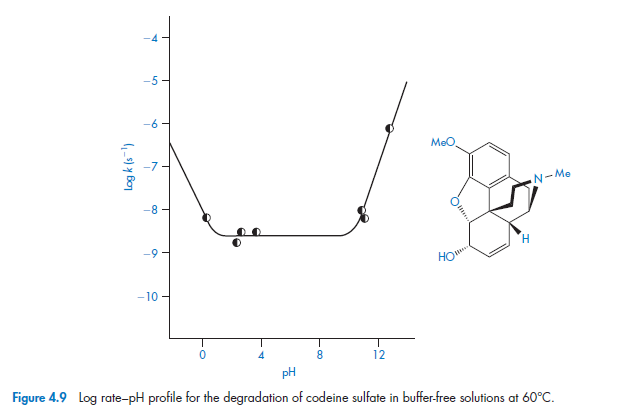
Как мы можем видеть из рис. 4.9, этот препарат очень стабилен в небуферизованном растворе в широком диапазоне рН, но относительно быстро деградирует в присутствии сильных кислот или оснований. Поскольку влияние буферных компонентов были удалены, этот участок позволяет рассчитать константы скорости для конкретной кислоты и основного катализа. После удаления условия для эффекта буфера из уравнения (4.44), мы имеем 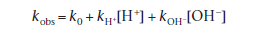
и, следовательно, участок постоянной измеренной скорости kobsпо отношению к концентрации ионов водорода [H +] при низком рН будет иметь градиент, равный константе скорости в присутствии кислотного катализатора.
Точно так же, конечно, если мы наносим kobs против [OH-] при высоком значении рН, градиент будет константой скорости при основном катализе гидролиза. Пример 4.4 иллюстрирует вычисление этих каталитических коэффициентов (ОВ его почему то нет в примерах задач)

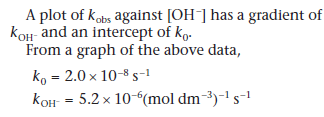
Пример на кодеине сульфате с задачей
Разрушение кодеина частично зависит от действия буферов. Скорость его гидролиза в 0,05 моль/л фосфатного буфера при pHравном 7 почти в 20 раз быстрее, чем в растворе без буфера при этой же pH, таким образом кодеин – хорошее вещество, например, для определения влияния компонентов буфера на частоту разрушения вещества.
В фосфатных буферах нейтральной реакции в основном содержатся H2PO4- и HPO42-, каждый из которых может действовать катализатором разрушения кодеина. Чтобы выяснить, какое вещество из них является более сильным катализатором, мы можем рассмотреть экспериментальные данные следующим образом. В растворах с нейтральной реакцией среды мы можем записать следующее уравнение для исследуемой константы скорости:
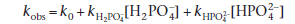
ИлиKobs = k0 + k`BT
где kH2PO4-и k HPO42- константы скорости катализа с помощью иона H2PO4- и HPO42-соответственно, и BTбудет иметь точку пересечения k0и наклон k`.
Чтобы найти значения каталитических коэффициентов, мы переводим уравнение в следующую линейную форму:
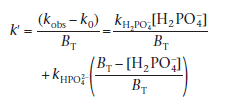
Теперь мы можем увидеть, что есть и второй график зависимости кажущейся константы скорости k` от кислотного компонента буфера, то есть зависимость [H2PO4-/ BT]будет иметь точку пересечения в [H2PO4-/ BT] = 0 равную k HPO42- . Более того, значение k` в [H2PO4-/ BT] = 1 является другим каталитическим коэффициентом k HPO4
Вот как раз задача из примеров для лучшего понимания
Задача 3.5 Расчет каталитических коэффициентов для буферов
Следующие данные были получены для гидролитической константы скорости k сульфата кодеина при 100 °С в фосфатных буферах различной общей концентрации BT при значениях рН от 6 до 8:

Если доля присутствующих в буферах растворов при рН 6 составляет 0,74 и при рН 8 - 0,23, определите графически каталитические коэффициенты для вида буферов (a) H2PO4- и (b) HPO42-.
Ответ:
Из уравнения (4.46), график kobs против BT имеет перехват k0 и градиент k’. Поэтому начертите kobs против BT из приведенных данных при каждом рН и измерьте градиент графика.
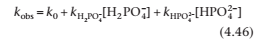
Из графика:
k' при pH 6 = 1,7 × 10−5 (моль дм−3)−1 сек−1
k' при pH 8 = 4,0 × 10−5 (моль дм−3)−1 сек−1.
Из уравнения (4.47), график k’ против фракции кислотного компонента буфера, [H2PO4−]/BT, имеет перехват kHPO4−,
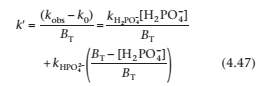
Когда [H2PO4−]/BT = 1, k’ = kH2PO4−
Из графика,
kHPO42−= 5,1 × 10−5 (моль дм−3)−1 сек−1
kH2PO42−= 0,5 × 10−5 (мольдм−3)−1сек−1
