Активность лекарственных веществ в ионизированной форме
Большая часть лекарственных веществ при попадании в водную среду образуют соли, которые при диссоциации проявляют электролитические свойства. У простых солей, таких как Эфедрина гидрохлорид соотношение компонентов внутри молекулы 1:1 (1,1 – валентный электролит), т.е. при диссоциации один моль вещества даёт катион и анион Clˉ. Другие соли проявляют более сложный характер при ионизации, например, эфедрина сульфат с соотношением компонентов 1:2, т.е. каждый моль вещества даёт два моля катиона и один моль 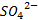 иона.
иона.
Активность каждого иона определяется коэффициентом активности этого иона и его концентрацией( или моляльной m, вместо молярной С) :
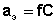 ;
; 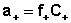 ;
; 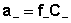
Катион и анион могут иметь различную ионную активность в растворе, что делает невозможным определение ионной активности в растворе каждого из них по отдельности в ходе эксперимента. Поэтому необходимо использовать: средняя ионная активность, средний коэффициент активности иона, и средняя моляльная концентрация иона/
γ+-=a+-/ m+-
Значение среднего коэффициента активности иона может быть определено экспериментально несколькими способами, включая измерение электродвижущей силы (ЭДС), определение растворимости и коллигативных свойств раствора.
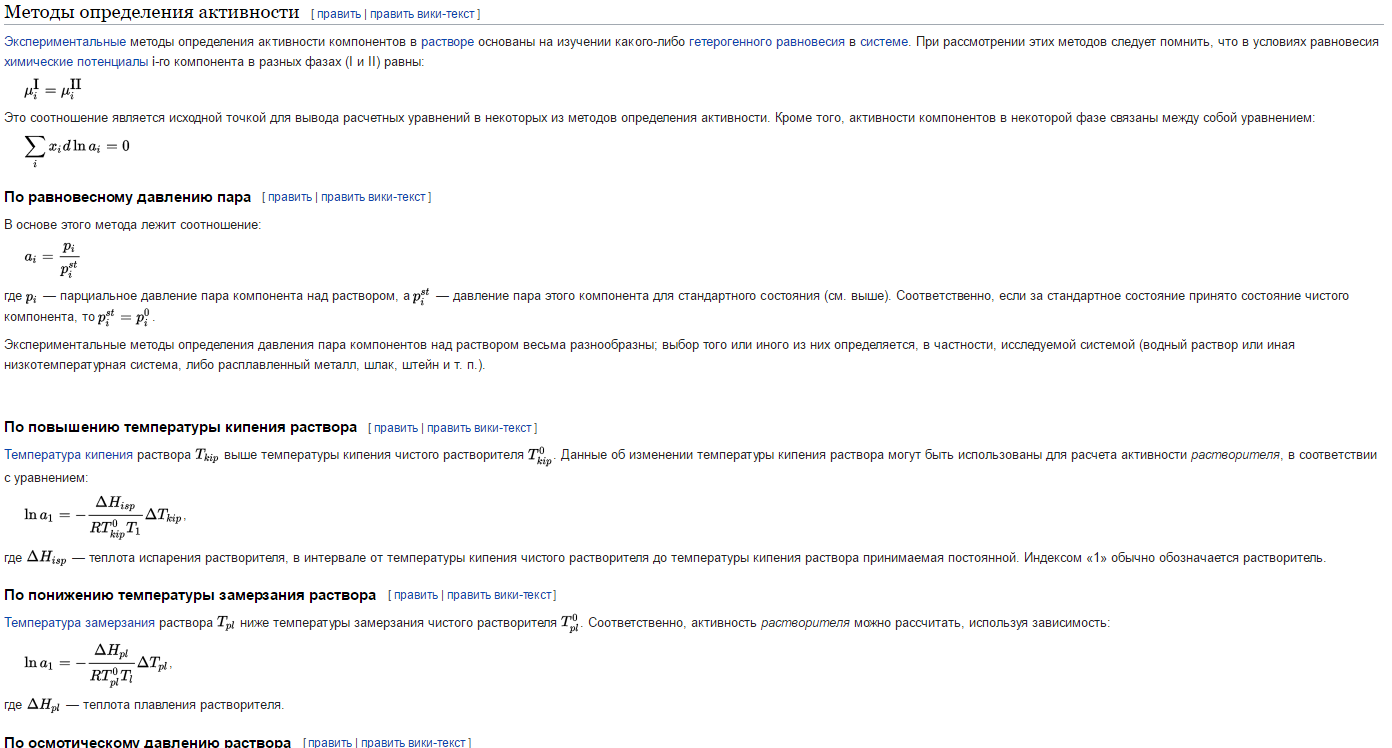
В очень разбавленных растворов(I<0.02 mol kg-1.)возможно рассчитать теоретически, использую теорию Дебая – Хюккеля, согласно которой каждый ион действием своего электрического заряда поляризует окружение и образует вокруг себя некоторое преобладание ионов противоположного знака — так называемое ионное облако. Энергия электростатического взаимодействия связана с химическим потенциалом иона , поэтому для разбавленных растворов можно использовать следующее выражение
− log γ+-= z+z-A√I
где z – это валентности ионов, А – константа, значение которой определяется диэлектрической проницаемостью растворителя и температурой ( А = 0.509 в воде при 298 К), а I – ионная сила раствора, (равна полусумме концентраций всех ионов, умноженных на квадрат их заряда)
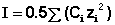 (в случае расчета через молялную концентрацию используется m всесто молярной С)
(в случае расчета через молялную концентрацию используется m всесто молярной С)
(т.е. для 1 : 1-валентных электролитов ионная сила численно равна моляльности, для 1 : 2-валентных электролитов I=3m, а для 2 : 2-валентных электролитов I=4m. (как в аналите))
При более высоких концентрациях(I меньше 0.1 моль/кг.) растворенного вещества в растворе следует воспользоваться представленной ниже формулой :
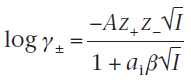
где ai – это среднее расстояние между ионами или средний эффективный ионный диаметр, в – константа, значение которой зависит от типа растворителя и температуры. При сближении образовавшийся продуктai в может быть взят как единица раствора, что упрощает уравнение.
Активность растворителя
Экспериментально активность растворителя a1 может быть установлена как отношение давления насыщенного пара p1 растворителя в растворе к давлению насыщенного пара чистого растворителя p2, то есть: a1 = p1/p2 = y1x1, г
де y1 – коэффициент активности растворителя и x1 – молярная концентрация растворителя.
Отношение между активностями компонентов раствора выражается уравнением Гиббса-Дюгеля: x1d(lna1) + x2d(lna2) = 0, которое дает возможность определения активности растворенного вещества, используя расчеты с давлением пара.
