Общие правила техники безопасности при работе в химической лаборатории
Содержание
Общие правила техники безопасности при работе в химической лаборатории.Инструкция по охране труда для обучающихся при работе в кабинете химии.Оказание медицинской помощи…………………………………………………........................................3
Практическаяработа №1Моделирование построения Периодической таблицы химических элементов. ………………………………………………………………………8
Лабораторная работа №1Приготовление суспензии карбоната кальция в воде. Получение эмульсии моторного масла. Ознакомление со свойствами дисперсных систем.
Приготовление дисперсных систем. …………………………………………………………14
Практическая работа № 2Приготовление раствора заданной концентрации…………………………………………………………………………………...18
Лабораторная работа №2Свойства кислот, оснований и солей. Гидролиз солей различного типа.………………………………………………………………………………..22
Лабораторная работа №3Химические реакции. ………………………………………...29
Лабораторная работа №4 Химические свойства металлов………………………............33
Лабораторная работа №5Получение, собирание и распознавание газов. Решение экспериментальных задач……………………………………………………………………...37
Практическая работа №3Изготовление моделей молекул органических веществ. ….....41
Лабораторная работа №6Кислородсодержащие органические соединения…………… 45
Литература……………………………………………………………………………………..50
ИНСТРУКЦИЯ ПО ОХРАНЕ ТРУДА ДЛЯ ОБУЧАЮЩИХСЯПРИ РАБОТЕ В КАБИНЕТЕ ХИМИИ
I. Общие положения
1. Соблюдение требований настоящей инструкции обязательно для всех обучающихся, работающих в кабинете химии.
2. Студенты могут находиться в кабинете только в присутствии преподавателя; пребывание обучающихся в помещении лаборантской не допускается.
3. Присутствие посторонних лиц в кабинете химии во время эксперимента допускается только с разрешения преподавателя.
4. В кабинете химии запрещается принимать пищу и напитки.
5. Обучающимся запрещается выносить из кабинета и вносить в него любые вещества без разрешения преподавателя.
6. Не допускается загромождение проходов портфелями и сумками.
7. Во время работы в кабинете химии обучающиеся должны соблюдать чистоту, порядок на рабочем месте, а также четко следовать правилам техники безопасности.
8. Студентам запрещается бегать по кабинету, шуметь и устраивать игры.
9. Не допускается нахождение студентов в кабинете химии во время его проветривания.
10. Обучающиеся, присутствующие на лабораторной или практической работе без халата, непосредственно к проведению эксперимента не допускаются.
II. Требования безопасности перед началом работы
1. Перед проведением экспериментальной работы каждый студент должен надеть халат. Халат должен быть из хлопчатобумажной ткани, застегиваться только спереди, манжеты рукавов должны быть на пуговицах. Длина халата — ниже
колен. Стирать халат, испачканный химическими реактивами, необходимо отдельно от остального нательного белья.
2. При проведении эксперимента, связанного с нагреванием жидкостей до температуры кипения, использованием разъедающих растворов, обучающиеся должны пользоваться средствами индивидуальной защиты (по указанию преподавателя).
3. Студенты, имеющие длинные волосы, не должны оставлять их в распущенном виде, чтобы исключить возможность их соприкосновения с лабораторным оборудованием, реактивами и тем более — с открытым огнем.
4. Прежде, чем приступить к выполнению эксперимента, обучающиеся должны по учебнику или инструктивной карточке изучить и уяснить порядок выполнения предстоящей работы.
5. Студенты обязаны внимательно выслушать инструктаж преподавателя по технике безопасности в соответствии с особенностями предстоящей работы. Текущий инструктаж по технике безопасности регистрируется в журнале. Приступать к проведению эксперимента обучающиеся могут только с разрешения преподавателя.
III. Требования безопасности во время работы
1. Во время работы в кабинете химии обучающиеся должны быть максимально внимательными, дисциплинированными, строго следовать указаниям преподавателя, соблюдать тишину, поддерживать чистоту и порядок на рабочем месте.
2. Во время демонстрационных опытов обучающиеся должны находиться на своих рабочих местах или пересесть по указанию преподавателя на другое, более безопасное место.
3. При выполнении лабораторных и практических работ обучающиеся должны неукоснительно соблюдать правила техники безопасности, следить, чтобы вещества не попадали на кожу лица и рук, так как многие из них вызывают раздражение
кожи и слизистых оболочек.
4. Никакие вещества в лаборатории нельзя пробовать на вкус! Нюхать вещества можно, лишь осторожно направляя на себя их пары или газы легким движением руки, а не наклоняясь к сосуду и не вдыхая полной грудью.
5. При выполнении лабораторных работ студенты должны точно повторять действия преподавателя, показывающего, как нужно правильно проводить эксперимент.
6. Подготовленный к работе прибор студенты должны показать преподавателю или лаборанту.
7. По первому требованию преподавателя студенты обязаны немедленно прекратить выполнение работы (эксперимента). Возобновление работы возможно только с разрешения преподавателя.
8. Студентам запрещается самостоятельно проводить любые опыты, не предусмотренные в данной работе.
9. Студентам запрещается выливать в канализацию растворы и органические жидкости.
10. Обо всех разлитых и рассыпанных реактивах обучающиеся должны немедленно сообщить преподавателю или лаборанту. Студентам запрещается самостоятельно убирать любые вещества.
11. Обо всех неполадках в работе оборудования, водопровода, электросети и т.п. студенты обязаны сообщить преподавателю или лаборанту. Студентам запрещается самостоятельно устранять неисправности.
12. При получении травм (порезы, ожоги и т. п.), а также при плохом самочувствии студенты должны немедленно сообщить об этом преподавателю или лаборанту.
13. Во время работы студентам запрещается переходить на другое рабочее место без разрешения преподавателя.
14. Студентам запрещается брать вещества и какое-либо оборудование с незадействованных на данный момент рабочих мест.
15. Недопустимо во время работы перебрасывать друг другу какие-либо вещи (учебники, тетради, ручки и др.).
16. Запрещается оставлять без присмотра включенные нагревательные приборы, а также зажигать горелки и спиртовки без надобности.
IV. Требования безопасности по окончании работы
1. Уборка рабочих мест по окончании работы производится в соответствии с указаниями преподавателя.
2. Студенты должны привести в порядок свое рабочее место, сдать преподавателю или лаборанту дополнительные реактивы и оборудование.
ОКАЗАНИЕ МЕДИЦИНСКОЙ ПОМОЩИ
Во всех случаях после оказания первой медицинской помощи следует обратиться в медицинское учреждение!
1.Отравление газами:чистый воздух, покой.
2. Отравление парами брома:дать понюхать с ватки нашатырный спирт (10%), затем промыть слизистые оболочки носа и горла 2%-м раствором питьевой соды.
3. Ожоги:при любом ожоге запрещается пользоваться жирами для обработки обожженного участка, а также применять красящие вещества (растворы перманганата калия, бриллиантовой зелени, йодной настойки).
Ожог первой степениобрабатывают этиловым спиртом и накладывают сухую стерильную повязку. Во всех остальных случаях накладывают стерильную повязку после охлаждения места ожога и обращаются в медпункт.
Попадание на кожу разбавленных растворов кислот и щелочей:стряхнуть видимые капли раствора и смыть остальное широкой струей прохладной воды или душем. Запрещаетсяобрабатывать пораженный участок увлажненным тампоном. Первая помощь. Пораженный участок кожи промывают сильно скользящей струей холодной воды в течение 10—15 мин. После промывки на обожженное место накладывают пропитанную водным 2%-м раствором питьевой соды марлевую повязку или ватный тампон. Через 10 мин. повязку снимают, кожу обмывают, осторожно удаляют влагу фильтровальной бумагой или мягкой тканью и смазывают глицерином для уменьшения болевых ощущений.
При оказании первой помощи необходимо немедленно каким-либо предметом удалить приставшие к коже кусочки щелочи и промыть пораженное место обильной струей воды. Щелочь смывается плохо, промывание должно быть продолжительным (10—15 мин.) и тщательным. Для нейтрализации проникшей в поры кожи щелочи на пораженное место после промывания накладывают повязку из марли или ватный тампон, пропитанные 5%-м раствором уксусной кислоты. Через 10 мин. повязку снимают, кожу обмывают, осторожно удаляют воду фильтровальной бумагой или мягкой тканью и смазывают глицерином для уменьшения болевых ощущений.
4. Отравление кислотами:выпить 4—5 стаканов теплой воды и вызвать рвоту, затем выпить столько же взвеси оксида магния в воде и снова вызвать рвоту. После этого сделать два промывания желудка чистой теплой водой. Общий объем жидкости не менее 6литров.
5. Отравление щелочами:выпить 4—5 стаканов теплой воды и вызвать рвоту, затем выпить столько же 2%-го раствора уксусной кислоты. После этого сделать два промывания чистой теплой водой.
6. Помощь при порезах:
а) в первую очередь, необходимо остановить кровотечение (жгут, пережатие сосуда, давящая повязка);
б) если рана загрязнена, грязь удаляют только вокруг нее, но, ни в коем случае — из глубинных слоев раны. Кожу вокруг раны обеззараживают йодной настойкой или раствором бриллиантовой зелени;
в) после обработки рану закрывают стерильной салфеткой так, чтобы перекрыть края раны, и плотно прибинтовывают обычным бинтом;
г) после получения первой медицинской помощи обращаются в медпункт
7.Обработка микротравм:
Небольшие раны после остановки кровотечения обрабатывают пленкообразующими препаратами — клеем БФ-6, жидкостью Новикова. Возможно использование бактерицидного пластыря.
8. Первая помощь при ушибах— покой поврежденному органу. На область ушиба накладывают давящую повязку и холод (например, лед в полиэтиленовом мешочке). Ушибленному органу придают приподнятое положение. Если ушиб сильный, после
оказания первой помощи необходимо отправить пострадавшего к врачу.
9. Ушиб головы:пострадавшему обеспечивают полный покой, на место ушиба кладут холодный компресс и вызывают скорую помощь.
10. Попадание в глаза инородных тел:разрешается удалить инородное тело влажным ватным или марлевым тампоном. Затем промывают глаз водой из фонтанчика не менее 7-10 минут. Для подачи воды допускается пользование чайником или
лабораторной промывалкой.
11. Попадание в глаза едких жидкостей:глаз промывают водой, как указано в п. 10, 2%-м раствором борной кислоты или питьевой соды (в зависимости от характера попавшего вещества). После ополаскивания глаз чистой водой под веки необходимо ввести 2-3 капли 30%-го раствора альбуцида и направить пострадавшего в медпункт.
Практическая работа №1
Тема работы:Моделирование построения Периодической таблицы химических элементов.
Цель:изучить структуру и состав периодической таблицы химических элементов,
закрепить представление о строении вещества.
Ход работы
Используя ранее полученные знания при изучении тем: «Основные понятия и законы химии», «Периодический закон и периодическая система химических элементов Д.И. Менделеева в свете учения о строении атома»:
•выполнить задание №1
•из каждого последующего задания выполнить один из вариантов, указанных преподавателем.
Задание № 1
Теоретическая часть
Периодический закон и Периодическая система химических элементов Д.И. Менделеева — основа современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе, и поэтому никогда не потеряют своего значения. Открытие Д. И. Менделеева позволило предсказать существование неизвестных элементов, спрогнозировать их свойства, исправить неверно определенные атомные массы уже известных элементов.
В основу своей работы по классификации химических элементов Д. И. Менделеев положил два их основных и постоянных признака: атомную массу и свойства образуемых этими элементами веществ. Он выписал на карточки все известные сведения об открытых и изученных в то время химических элементах и их соединениях. Сопоставляя эти сведения, ученый составил естественные группы сходных по свойствам элементов. При этом он обнаружил, что свойства элементов в некоторых пределах изменяются линейно (монотонно усиливаются или ослабевают), затем после резкого скачка периодически (т.е. через определенное число элементов) повторяются. На основании своих наблюдений 1 марта 1869 г. Д. И. Менделеев сформулировал Периодический закон:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов (от их относительных атомных масс).
На основании Периодического закона Д. И. Менделеев создал свою знаменитую таблицу химических элементов — графическое отображение Периодического закона. В школьной практике чаще используют прототип первоначальной менделеевской таблицы — короткопериодный ее вариант. В настоящее время применяют и другие формы, например длиннопериодную таблицу. Уязвимым местом Периодического закона сразу после его открытия была невозможность объяснения причины циклического повторения свойств элементов увеличением относительной массы их атомов. Более того, несколько пар элементов расположены в Периодической системе с нарушением порядка роста значения относительной атомной массы. Например, аргон с относительной атомной массой 39,948 занимает 18-е место, а калий, относительная атомная масса которого 39,102, имеет порядковый номер 19.
Только с открытием строения атомного ядра и установлением физического смысла порядкового (атомного) номера элемента стало понятно, что элементы в Периодической системе расположены в порядке увеличения положительного заряда их атомных ядер. С этой точки зрения никакого нарушения в последовательности элементов: 18Аг -19К, 27Со - 28Ni, 52Те -53I, 90Th - 91Ра — не существует.
Следовательно, в современной трактовке Периодический закон устанавливает:Свойства химических элементов и образуемых ими веществ находятся в периодической зависимости от величины заряда ихатомных ядер.
Теоретическая часть
Зная формулы веществ, состоящих из двух химических элементов, и валентность одного из них, можно определить валентность другого элемента.
Например: дана формула оксида меди Cu2O, необходимо определить валентность меди. Валентность кислорода постоянная и равна II, а на один атом кислорода приходится 2 атома меди. Следовательно, валентность меди равнаI.
| Валентность | С постоянной валентностью | Примеры формул соединений | |
| I | H, Na, K, Li | H2O, Na2O | |
| II | O, Be, Mg, Ca, Ba, Zn | MgO, CaO | |
| III | Al, B | Al2O3 | |
| Валентность | С переменной валентностью | Примеры формул соединений | |
| I и II | Cu | Cu2O, CuO | |
| II и III | Fe, Co, Ni | FeO, Fe2O3 | |
| II и IV | Sn,Pb | SnO, SnO2 | |
| III и V | Р | РН3, Р2О5 | |
| II, III и VI | Cr | CrO, Cr2O3, CrO3 | |
| II, IV и VI | S | H2S, SO2, SO3 | |
Определитьвалентностиследующихэлементов:
Вариант 1.SiH4, CrO3, H2S, CO2, SO3, Fe2O3
Вариант 2.CO,HCl, HBr, Cl2O5, SO2,РН3
Bариант 3.Al2O3, P2O5, NO2, Mn2O7,Cl2O7, Cr2O3
Вариант 4.SiO2, B2O3, SiH4, N2O5,MnO, N2O3
_____________________________________________________________________________
Задание № 3.
Теоретическая часть
Относительная молекулярная масса -сумма всех относительных атомных масс входящих в молекулу атомов химических элементов.
Мr = Аr1 * n1+ Ar2* n2+ Аr3 * n3…
Где Мr – относительная молекулярная масса вещества
Аr1 , Ar2, Аr3 … – относительные атомные массы элементов входящих в состав этого вещества
n1, n2, n3 – индексы при химических знаках химических элементов.
Пример: Вычислить относительную молекулярную массу молекулы серной кислоты (H2SO4)
| Последовательность действий | Выполнение действий |
| 1. Записать молекулярную формулу серной кислоты. | H2SO4 |
| 2. Подсчитать по формуле относительную молекулярную массу серной кислоты, подставив в формулу относительные атомные массы элементов и их индексы. Записать ответ. | Mr (H2SO4 ) = Ar (H)· n + Ar (S)· n + Ar (O)· n = 1·2 + 32·1 + 16·4=98 Ответ: Mr (H2SO4 ) = 98. |
Определить относительную молекулярную массу веществ:
Вариант 1.Cu2O, KNO3, Na2Si03, Н3РО4
Вариант 2.A12(S04)3, H2SO4 , K2S, Mg(OH)2
Вариант3.SO3, CaCO3, H2SO3, NH4OH
Вариант 4. P2O3, Zn(OH)2, H2SiO3, AlCl3
_____________________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание № 4.
Теоретическая часть
«Атом» - греч «неделимый». Атомы, тем не менее, имеют сложное строение.
В центре – атомное ядро, имеющее чрезвычайно малые размеры по сравнению с размерами атома. В состав ядра входят положительные частицы – протоны (р+) и нейтральные частицы – нейтроны (n0). Таким образом, ядро атома заряжено положительно.
Атом— это электронейтральная частица, имеющая положительно заряженное ядро, вокруг которого движутся отрицательно заряженные электроны. Атом является электронейтральной частицей, поэтому число электронов должно быть равно числу протонов, т. е. заряду ядра.
Заряд ядра = Число протонов = Число электронов
Протоны – частицы с положительным зарядом +1 и относительной массой 1.
Нейтроны– электронейтральные частицы с относительной массой 1.
Положительный заряд атома равен числу протонов.
Лабораторнаяработа№1
Тема работы:Приготовление суспензии карбоната кальция в воде. Получение эмульсии моторного масла. Ознакомление со свойствами дисперсных систем.Приготовление дисперсных систем.
Цель:научитьсяполучать дисперсные системы и исследовать их свойства
Техника безопасности
1. Работа с нагревательными приборами.
2. Работа с химической посудой.
3. Работа с химическими реактивами.
Оборудование и реактивы:штатив, пробирки, стеклянный стакан,карбонат кальция, масло,мука, желатин,раствор глицерина, дистиллированная вода.
Задание:Выполните опыты и оформите отчет, заполнив таблицу.
Теоретическая часть
Чистые вещества в природе встречаются очень редко, чаще всего встречаются смеси. Смеси разных веществ в различных агрегатных состояниях могут образовывать гомогенные(растворы) и гетерогенные(дисперсные ) системы.
Дисперсными называют гетерогенные системы , в которых одно вещество - дисперсная фаза (их может быть несколько) в виде очень мелких частиц равномерно распределено в объеме другого -дисперсионной среде.
Среда и фазы находятся в разных агрегатных состояниях – твердом, жидком и газообразном. По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся 2 группы:
- Грубодисперсные(взвеси) с размерами частиц более 100 нм. Это непрозрачные системы, в которых фаза и среда легко разделяются отстаиванием или фильтрованием. Это - эмульсии, суспензии, аэрозоли.
- Тонкодисперсные-с размерами частиц от 100 до 1 нм. Фаза и среда в таких системах отстаиванием разделяются с трудом. Это: золи (коллоидные растворы- "клееподобные") и гели (студни).
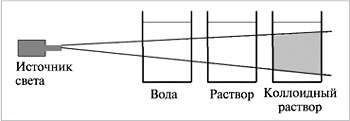 Коллоидные системы прозрачны и внешне похожи на истинные растворы, но отличаются от последних по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Это явление называют эффектом Тиндаля. При определенных условиях в коллоидном растворе может начаться процесс коагуляции. Коллоидные системы прозрачны и внешне похожи на истинные растворы, но отличаются от последних по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Это явление называют эффектом Тиндаля. При определенных условиях в коллоидном растворе может начаться процесс коагуляции. | |
Коагуляция– явление слипания коллоидных частиц и выпадения их в осадок. При этом коллоидный раствор превращается в суспензию или гель. Гели или студни представляют собой студенистые осадки, образующиеся при коагуляции золей. Со временем структура гелей нарушается (отслаивается) – из них выделяется вода. Это явление синерезиса. Различают 8 типов дисперсных систем.(д/с + д/ф)
|
Ход работы
| Опыт | Результаты | |
| Опыт №1 Приготовление суспензии карбоната кальция в воде. | В пробирку влить 4-5мл воды и всыпать 1-2 ложечки карбоната кальция. Пробирку закрыть резиновой пробкой и встряхнуть несколько раз. | Что наблюдаете? Внешний вид и видимость частиц: ______________________________________________________________________ ___________________________________ Способность осаждаться и способность к коагуляции ______________________________________________________________________ ______________________________________________________________________ |
| Опыт №2 Приготовление эмульсии масла в воде и изучение ее свойств | В пробирку влить 4-5мл воды и 1-2 мл масла, закрыть резиновой пробкой и встряхнуть несколько раз. Изучить свойства эмульсии. Добавить 2-3 капли глицерина. | Что наблюдаете? Внешний вид и видимость частиц: _________________________________ _________________________________ _________________________________ Способность осаждаться и способность к коагуляции _________________________________ _________________________________ _________________________________ Внешний вид после добавления глицерина ___________________________________ ___________________________________ ___________________________________ |
| Опыт №3 Приготовление коллоидного раствора и изучение его свойств | В стеклянный стакан с горячей водой внести 1-2 ложечки муки (или желатина), тщательно перемешать. Пропустить через раствор луч света фонарика на фоне темной бумаги | Что наблюдаете? Внешний вид и видимость частиц _________________________________ _________________________________ _________________________________ _________________________________ _________________________________ Способность осаждаться и способность к коагуляции_______________________ _________________________________ _________________________________ _________________________________ Наблюдается ли эффект Тиндаля __________________________________ __________________________________ __________________________________ __________________________________ |
Общий вывод:_________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________
Вопросы для закрепления материала:
1. Что такое дисперсные системы? Из каких компонентов они состоят?__________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
2. Как классифицируют дисперсные системы по размерам частиц дисперсной фазы?_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Что такое суспензии и эмульсии?______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________
4. Как называются частицы дисперсной фазы в коллоидных растворах?_____________________________________________________________________________ __________________________________________________________________________________________________________________________________________________________
5. Что такое коагуляция и чем она вызывается?___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
6. Заполните таблицу
Вариант 1
| Дисперсионная среда | Дисперсная фаза | Система | Пример |
| Туман | |||
| Взбитые сливки | |||
| Стекло | |||
| Пасты | |||
| Поролон | |||
| Дым | |||
| Мази | |||
| Плазма крови |
Вариант 2
| Дисперсионная среда | Дисперсная фаза | Система | Пример |
| Горные породы | |||
| Керамика | |||
| Облака | |||
| Цитоплазма | |||
| Желатин | |||
| Смог | |||
| Лимонад | |||
| Речной ил |
Условия выполнения задания
1.Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: 90 мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Практическая работа № 2
Тема работы:Приготовление раствора заданной концентрации
Цель:научиться готовить раствор заданной концентрации, используя весы и мерную посуду.
Техника безопасности
1. Работа с химической посудой.
2. Работа с химическими реактивами.
Оборудование и реактивы: химический стакан объемом 50 мл, стеклянная палочка с резиновым наконечником, весы с разновесами, стеклянная лопаточка, мерный цилиндр, хлорид натрия, хлорид калия, карбонат натрия, дистиллированная вода
Задание:Выполните опыты и оформите отчет
Теоретическая часть
Растворы — гомогенные (однородные) системы переменного состава, которые содержат два или несколько компонентов.
Растворителем чаще всего является то вещество, которое в чистом виде имеет тоже агрегатное состояние, что и раствор, либо присутствует в избытке. По агрегатному состоянию различают растворы: жидкие, твердые, газообразные. По соотношению растворителя и растворенного вещества: разбавленные, концентрированные, насыщенные, ненасыщенные, перенасыщенные. Состав раствора обычно передается содержанием в нем растворимого вещества в виде массовой доли, процентной концентраций и молярности.
Массовой долей растворенного вещества называется отношение массы растворенного вещества к массе раствора:
где ω— массовая доля растворенного вещества, выраженная в долях единицы; m(в-ва) — масса растворенного вещества, г; m(р-ра) — масса раствора, г.
Массовую долю можно выражать также в процентах: Массовую долю растворенного вещества, выраженную в процентах, часто называют процентной концентрацией раствора.
Массу раствора можно рассчитать по формулам:
m(р-ра) = m(растворителя) + m(в-ва)
m(р-ра) = р • V
где V — объем раствора, мл; р — плотность раствора, г/мл.
Молярная концентрация показывает число молей растворенного вещества в одном литре раствора.Молярную концентрацию можно рассчитать по формуле:
 , моль/л
, моль/л
где С — молярная концентрация, моль/л; п — количество растворенного вещества, моль;  ,моль;V — объем раствора, л
,моль;V — объем раствора, л
Ход работы
Задание 1. Приготовление раствора соли с определенной массовой долей вещества.
Вариант 1.Приготовьте 20 г водного раствора хлорида натрия с массовой долей соли 5%.
Вариант 2. Приготовьте 25 г водного раствора хлорида калия с массовой долей соли 4%.
Вариант 3. Приготовьте 50 г водного раствора карбоната натрия с массовой долей соли
2%.
Произведите расчеты: определите какую массу соли и воды потребуется взять для приготовления раствора указанного в условии задачи.
| Дано: m (раствора) = г w( ) = % Найти: mвещества - ? m (H2O) - ? | Решение: |
| Расчет по формуле |
Приготовьте раствор. Для этого:
1. Отвесьте соль и поместите ее в стакан.
2. Отмерьте измерительным цилиндром необходимый объем воды и вылейте в стакан с навеской соли.
Внимание! При отмеривании жидкости глаз наблюдателя должен находиться в одной плоскости с уровнем жидкости. Уровень жидкости прозрачных растворов устанавливают по нижнему мениску.
Задание 2. Приготовление раствора с заданной молярной концентрацией.
Вариант 1. Приготовить 250 мл раствора хлорида калия, молярная концентрация которого
0,2 моль/л.
Вариант 2. Приготовить 200 мл раствора карбоната натрия, молярная концентрация
которого 0,5 моль/л.
Вариант 3. Приготовить 300 мл раствора хлорида натрия, молярная концентрация
которого 0,1 моль/л.
Произведите расчеты: рассчитайте массу растворенного вещества в 1000 мл раствора заданной молярной концентрации; рассчитайте массу растворенного вещества в предложенном объеме раствора
| Дано: Vр-ра = мл С = моль/л Найти: mвещества - ? | Решение: |
| Расчет по формуле |
Приготовьте раствор.
В соответствии с расчетами возьмите навеску соли, поместите ее в мерный стакан и добавьте немного воды (примерно 7-10 мл). Помешивая стеклянной палочкой, растворите полностью соль, а затем прилейте воды до необходимого по условию задачи объема.
Общий вывод:________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
Вопросы для закрепления материала:
Вариант 1
1. Требуется приготовить раствор массой 500 г с массовой долей хлорида кальция 14%. Рассчитайте массы требуемых хлорида кальция и воды.
2. В 300 мл раствора содержится8,4 г гидроксида калия. Чему равна молярная концентрация КОН в этом растворе?
Вариант 2
1. К 120 г раствора фруктозы с массовой долей 14% прилили 180 мл воды. Какова массовая доля (%) фруктозы в полученном растворе?
2. Какую массу фосфорной кислоты надо взять для приготовления раствора объемом 500 мл, если молярная концентрацияН3РО4 равна 0,02 моль/л?
Вариант 3
1. Рассчитайте массуKМnO4 и объем воды, необходимые для приготовления100 г
3%-ного раствора перманганатакалия.
2. Вычислите молярную концентрацию раствора, содержащего в 200 мл 12,6 г азотной кислоты.
Вариант 4
1. При выпаривании 300 г 5%-ного раствора сахара получили раствор массой240 г. Какова процентная концентрация полученного раствора?
2. Какую массу серной кислоты надо взять для приготовления раствора объемом 2,5 л, если молярная концентрация H2SO4равна 0,1 моль/л?
Вариант 5
1. Какие массы йода и спирта необходимы для приготовления 300 г раствора с массовой долей йода 5%?
2. Какая масса хлорида меди (II)CuCl2содержится в растворе объемом 15 л, если его молярная концентрация 0,3 моль/л?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Условия выполнения задания
1.Место (время) выполне
