Заключительный (городской) этап. Теоретический тур
Класс
1.Для определенности возьмем кислоту, которая будет при обычных условиях взаимодействовать с этими металлами, например, соляную:
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Пусть масса смеси – x г, тогда m(Mg) = 0,4x г, m(Al) = 0,6x г.Соответствующие количества веществ: ν(Mg) = 0,4x/24 моль, ν(Al) = 0,6x/27 моль. Количество водорода, выделяющегося в результате реакций, есть сумма 0,4x/24 + 3·0,6x/(27·2) = 0,05x моль. V(H2) = 22,4·0,05x = 1,12x = 2,016 (по условию). Т.е. x= 1,8 г.
Рекомендации к оцениванию:
1) Выбор кислоты 1 балл = 1 балл
2) Уравнения реакций по 2 балла 2·2 = 4 балла
3) Расчет массы смеси 5 баллов = 5 баллов
Замечание: не уравненная реакция оценивается в 1 балл.
ИТОГО 10 баллов
2.Количество электронов в стабильном ионе X составляет 2 + 2 + 6 + 2 + 6 = 18. Из схемы видно, что это двухзарядный катион. Т.е. элемент X содержит 20 электронов – это кальций Ca.
1) Ca + H2 → CaH2 (A);
2) Ca + Cl2 → CaCl2 (B);
3) 2Ca + O2 → 2CaO (C);
4) CaH2 + 2H2O → Ca(OH)2 + 2H2↑;
5) Ca(OH)2 + 2HCl → CaCl2 + 2H2O;
6) CaO + 2HI → CaI2 + H2O;
7) CaI2 + PbCl2 → CaCl2 + PbI2↓.
Рекомендации к оцениванию:
1) Обоснованное определение X 3 балла = 3 балла
2) Уравнения реакций по 1 баллу 1·7 = 7 баллов
Замечание: не уравненная реакция оценивается в 0 баллов.
ИТОГО 10 баллов
3. 1)
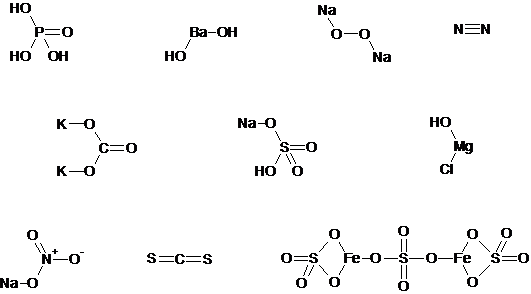
2)
| Соединение | Степень окисления | Валентность |
| Na2O2 | –1 | II |
| N2 | III | |
| NaNO3 | +5 | IV |
3) Только ковалентные полярные связи содержат H3PO4 и CS2.
Рекомендации к оцениванию:
1) Структурные формулы по 0,75 балла 0,75·10 = 7,5 баллов
2) Соединения, содержащие элемент с разными
значениями валентности и степени окисления, по 0,5 балла 0,5·3 = 1,5 балла
3) Соединения с ковалентными полярными связями по 0,5 балла 0,5·2 = 1 балл
Замечание: 2 пункт без правильно приведенных значений степеней окисления и валентностей оценивается в 0 баллов.
ИТОГО 10 баллов
4.К химическим явлениям относятся следующие:
1) появление ощущения свежести после грозы (при грозовом разряде идет реакция образования озона, который и обладает характерным запахом: 3O2 → 2O3);
5) восстановление блестящей поверхности при чистке серебряного изделия с помощью нашатырного спирта (со временем серебро медленно окисляется кислородом воздуха с образованием оксидной пленки Ag2O (черный), при обработке таких изделий нашатырным спиртом (водный раствор аммиака) происходит ее удаление за счет реакции: Ag2O + 4NH3·H2O → 2[Ag(NH3)2]OH + 3H2O;
6) образование пузырьков газа при обработке раны раствором перекиси водорода (под действием каталазы (фермент, содержащийся в крови) происходит разложение перекиси водорода: 2H2O2 → 2H2O + O2, а образование кислорода и определяет ее антисептические свойства).
Примеры явлений:
1) 4P + 5O2 → 2P2O5; такая реакция происходит при зажигании спички о терочную поверхность.
2) C + O2 → CO2; сжигание угля.
3) CH4 + 2O2 → CO2 + 2H2O; горение природного газа (метан CH4 – основной компонент).
4) 4Fe + 6H2O + 3O2 → 4Fe(OH)3; образование ржавчины на железной поверхности.
Рекомендации к оцениванию:
1) Классификация явлений по 0,75 балла 0,75·6 = 4,5 балла
2) Объяснения по 0,5 балла 0,5·3 = 1,5 балла
3) Примеры явлений по 1 баллу 1·4 = 4 балла
ИТОГО 10 баллов
5.1) mр-ра = 1,1·250 = 275 г; m(H2SO4) = 0,15·275 = 41,25 г; V(H2SO4) = 41,25/1,84 = 22,4 мл; V(H2O) = (275 – 41,25)/1 = 233,8 мл.
2) Растворилось ν(H2SO4) = 41,25/98 = 0,421 моль, количество выделившейся теплоты Q = 0,421·74,2 = 31,2 кДж. Пренебрегая теплообменом с окружающей средой, можно считать, что вся выделившаяся энергия пошла на нагревание раствора. Q = cmΔt; таким образом, раствор нагреется на Δt = Q/cm = 31200/(3560·0,275) = 32 °С.
3) Последовательность смешения имеет значение с точки зрения техники безопасности, а именно нужно приливать кислоту тонкой струйкой к воде. Вышеприведенные расчеты показали, насколько растворение серной кислоты в воде экзотермично. Т.е. если поменять последовательность, первые порции воды буквально «вскипят» на поверхности кислоты (ρ(H2O) < ρ(H2SO4)) и брызги полетят во все стороны.
Рекомендации к оцениванию:
1) Объем серной кислоты и воды по 1,5 балла 1,5·2 = 3 балла
2) Расчет Q и Δt по 2 балла 2·2 = 4 балла
3) Правильная последовательность смешения 1 балл = 1 балл
4) Объяснение 2 балла = 2 балла
ИТОГО 10 баллов
6.
| CaCO3 → CaO + CO2 CaO + H2O → Ca(OH)2 CO2 + C → 2CO 2CO + O2 → 2CO2 Ca(OH)2 + CO2 → CaCO3 + H2O | (А) – CaCO3 (Б) – CO2 (В) – CaO (Г) – Ca(OH)2 (Д) – C (Е) – CO |
Рекомендации к оцениванию:
1) Определение веществ по 1 баллу 1·6 = 6 баллов
2) Уравнения реакций по 0,8 балла 0,8·5 = 4 балла
ИТОГО 10 баллов
7. Обозначим неизвестный элемент буквой X. Выведем формулу исходного оксида. Для этого используем закон эквивалентов:
ω(X)/ω(O) = Mэкв(Х)/Mэкв(O), где Mэкв(Х) и Mэкв(O) – молярные эквивалентные массы.
ω(X) = 100 – 36,8 = 63,2%
Mэкв(Х) = M(X)/z, где M(X) – молярная масса металла, а z – его валентность в оксиде.
Mэкв(О) = M(О)/z, где M(О) – молярная масса кислорода (16 г/моль), а z – его валентность в оксиде (2). Тогда имеем: 63,2/36,8 = M(X)/8z, решая это уравнение, получим M(X) = 13,78∙z. При z=4 M(X) = 55 г/моль, что соответствует марганцу (элемент Х). Исходный оксид (вещество А) – MnO2.
Давление в колбе увеличилось вследствие образования газа. Газом может быть только кислород. Объём воздуха равен объёму колбы, т.е. равен 1 литру. Так как давление увеличилось в 2,12 раза по сравнению с исходным, то V(O2) = 2,12 – 1 = 1,12 л.
Выясним, что является веществом Б – марганец или оксид марганца. Для этого определим, весь ли кислород перешёл из MnO2 в газообразный кислород. m(O2) = ν ∙ M = V / Vm ∙ M = 1,12 / 22,4 ∙ 32 = 1,6 г. Масса кислорода в исходном оксиде: m(O) = ω(О) ∙ m(MnO2) = 0,368 ∙ 17,4 = 6,4 г. Не весь кислород перешёл из оксида в молекулярный кислород. Значит, вещество Б – это не марганец, а некий оксид марганца. Рассчитаем массовые доли элементов в нём.
В веществе Б m(O) = m(O)в МnO2 – m(O2) = 6,40 – 1,6 = 4,8 г. m(Б) = m(MnO2) – m(O2) = 17,4 – 1,6 = 15,8 г (по закону сохранения массы). ω(O)в в-ве Б = 4,8 / 15,8 = 0,304 или 30,4%. ω(Mn) = 100% – ω(O)в МnO2 = 100% – 30,4% = 69,6%. Выведем простейшую формулу вещества Б:
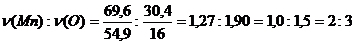
Следовательно, вещество Б – это Mn2O3.
Уравнение реакции:
4MnO2  2Mn2O3 + O2↑
2Mn2O3 + O2↑
Рекомендации к оцениванию:
1) Определение MnO2 = 5 баллов
2) Определение Mn2O3 = 4 балла
3) Уравнение реакции = 1 балл
ИТОГО 10 баллов
Класс
1. А) 4Na2SO3 = Na2S + 3Na2SO4; KClO3 = KCl + KClO4 (без кат.).
Б) NH4Cl = NH3↑ + HCl↑; 2N2O5 = 4NO2↑ + O2↑.
В) CaCO3 = CaO + CO2↑; Ag2O = 2Ag + O2↑.
Г) 2HgO = 2Hg + O2↑; NH4NO2 = N2↑ + 2H2O.
Д) Cu(OH)2 = CuO + H2O; 2Na2HPO4 = Na4P2O7 + H2O.
Рекомендации к оцениванию:
1) Уравнения реакций по 1 баллу 1∙10 = 10 баллов
ИТОГО 10 баллов
2. Неприятно пахнущие газы, продукты сгорания которых растворяются в воде с образованием кислоты – сероводород (H2S), оксид серы(IV) (SO2) и фосфин (PH3).
Уравнения реакций горения в кислороде:
2PH3 + 4O2 = P2O5 + 3H2O
2H2S + 4O2 = 2SO3 + 2H2O (кат.)
2SO2 + O2 = 2SO3 (кат.)
При пропускании в воду продуктов сгорания образуются:
P2O5 + 3H2O = 2H3PO4; SO3 + H2O = H2SO4.
Количество газа: 0,112/22,4 = 0,005 моль.
Количество щелочи: 0,1*0,1 = 0,01 моль.
Соотношение количеств кислоты и щелочи 1: 2
Уравнения реакций нейтрализации:
2NaOH + H3PO4 = Na2HPO4 + 2H2O
2NaOH + H2SO4 = Na2SO4 + 2H2O
HPO42– – очень слабая кислота, поэтому раствор гидрофосфата натрия имеет почти нейтральную (слабощелочную) реакцию.
Массовые доли натрия в гидрофосфате и сульфате одинаковы: 46/142 = 0,324.
Однако при нагревании до 600 K сульфат натрия устойчив, а гидрофосфат разлагается с образованием дифосфата натрия:
2Na2HPO4 = Na4P2O7 + H2O
Массовая доля натрия в дифосфате: 92/266 = 0,346.
Единственное решение:А - PH3; Б - Na2HPO4; В - Na4P2O7.
Рекомендации к оцениванию:
1) Вещества А, Б, В по 2 балла 2∙3 = 6 баллов
2) Уравнения реакций по 0,5 балла 0,5∙2 = 4 балла
ИТОГО 10 баллов
3.а) 2K4[Fe(CN)6] + Cl2 = 2K3[Fe(CN)6] + 2KCl;
б) 2KI + 2NO2= I2 + 2KNO2;
в) 3Na2SO3 + 2H NO3 = 3Na2SO4 + 2NO + H2O;
г) 4FeS + 7O2 = 2Fe2O3 + 4SO2;
д) 2Cu(NO3)2 + 4KI = 2CuI + I2 + 4KNO3;
е) 2Na2O2 + 2CO2= 2Na2CO3 + O2;
ж) 2S + 2NO2 = 2SO2 + N2;
з) 4H2O2 + H2S = H2SO4 + 4H2O;
и) 3MnS + 8HNO3 = 3Mn(NO3)2 + 3S + 2NO + 4H2O;
к) 3H2SeO3 + HClO3 = 3H2SeO4 + HCl.
Рекомендации к оцениванию:
1) Уравнения реакций по 1 баллу 1∙10 = 10 баллов
ИТОГО 10 баллов
4. Учитывая разности относительных атомных масс галогенов, методом подбора находим, какие галогены могут входить в состав галогенидов:
Cl и F: 35,5 – 19 = 16,5 ; Br и F: 80 – 19 = 61; I и F: 127 – 19 = 108;
Br и Cl: 80 – 35,5 = 44,5; I и Cl: 127 – 35,5 = 91,5; I и Br: 127 – 80 = 47.
Таким образом, условию задачи удовлетворяют Br и F.
А – относительная атомная масса металла. Тогда, согласно условию задачи:
(А + 80х)/(А + 19х) = 2,794, где х – валентность металла.
Решая это уравнение, находим А = 15х.
Подставляя численные значения валентности, находим относительную атомную массу металла:
х = 1, А = 15; х = 2, А = 30; х = 3, А = 45; х = 4, A = 60; х = 5, А = 75; х = 6, А = 90; х = 7, А = 105; х = 8, А = 120.
Из найденных величин относительной атомной массе металла соответствует только одна – 45, искомый металл – скандий.
Формулы галогенидов: ScF3 и ScBr3.
Некоторые свойства галогенидов скандия:
ScF3 + 3КF = К3[ScF6]
2ScF3 + 3Ca = 2Sc + 3CaF2
ScBr3 + 3NaOH = Sc(OH)3↓ + 3NaBr
ScBr3 + 3AgNO3 = 3AgBr↓ + Sc(NO3)3
2ScBr3 + 3Cl2 = 2ScCl3 + 3Br2
Рекомендации к оцениванию:
1) Нахождение галогенов 2 балла = 2 балла
2) Нахождение галогенидов 4 балла = 4 балла
3) Уравнения реакций 4 балла = 4 балла
ИТОГО 10 баллов
5. Переход нерастворимой соли в растворимые соединения может происходить в следующих случаях:
1) Кислотно-основные взаимодействия.
a) Действие кислой соли на осадок средней или основной соли:
MgCO3 + 2NaHSO4 = MgSO4 + Na2SO4 + H2O + CO2↑
Cu(OH)2*СuCO3 + 4NaHSO4 = 2CuSO4 + 2Na2SO4 + 3H2O + CO2↑
б) Действие гидролитически кислого раствора на среднюю или основную соль.
MgCO3 + 2AlCl3 + H2O = MgCl2 + 2Al(OH)Cl2 + CO2↑
Аналогично будет протекать реакция с основной солью. Раствор хлорида алюминия надо взять в большом избытке, чтобы избежать выпадения осадка основного хлорида алюминия.
2) Окислительно-восстановительные реакции:
Сu2S + 5Fe2(SO4)3 + 4H2O = 2CuSO4 + 10FeSO4 + 4H2SO4
(Реакция применяется для извлечения меди из бедных руд, проводится в гидротермальных условиях)
3) Образование комплексных солей:
AgBr + 2Na2S2O3 = NaBr + Na3[Ag(S2O3)2]
(Используется для фиксирования в фотографическом процессе.)
Рекомендации к оцениванию:
1) Кислотно-основное взаимодействие по 2 балла за каждый тип 2∙2 = 4 балла
2) Окислительно-восстановительные реакции 3 балла = 3 балла
3) Комплексообразование 3 балла = 3 балла
ИТОГО 10 баллов
6.Количество хромата калия в исходном растворе: (150*0,097)/194 = 0,075 моль. При добавлении оксида хрома (VI) протекает реакция:
K2CrO4 + CrO3 = K2Cr2O7 (1)
Пусть добавили х моль оксида хрома (VI). Тогда после реакции в растворе будут находиться: (0,075 – х ) моль K2CrO4 и х моль K2Cr2O7 (см. уравнение 1).
По условию в конечном растворе W(K2CrO4) = (0,075 – х)*194/(150 + 100х) = 0,0636.
Решая это уравнение, находим х = 0,025 моль.Значит, в конечном растворе имеется: 0,05 моль хромата и 0,025 моль дихромата.
При прокаливании твердого остатка разлагается только дихромат:
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 + 3O2↑ (2)
Твердый остаток состоит из K2CrO4 и Cr2O3 (см. уравнение 2).
Количество K2CrO4: (0,05 + 0,025) моль.
Количество Cr2O3: 0,0125 моль.
Масса твердого остатка: 0,075*194 + 0,0125*152 = 16,45 г.
W(K2CrO4) = 14,55/16,45 = 0,8845 или 88,45%.
W(Cr2O3) = 1,9/16,45 = 0,1155 или 11,55%.
Рекомендации к оцениванию:
1) Уравнения реакций (1) и (2) по 2 балла 2∙2 = 4 балла
2) Состав конечного раствора 2 балла = 2 балла
3) Состав твердого остатка 3 балла = 3 балла
4) Расчет массовых долей 1 балл = 1 балл
ИТОГО 10 баллов
7. 1) При электролизе водного раствора сульфата меди (II) могут протекать два процесса:
2CuSO4 + 2H2O = 2Cu↓ + O2↑ + 2H2SO4 (1)
2H2O = 2H2↑ + O2↑ (2), если полностью разложится CuSO4
Общее количество пропущенного электричества: 7,236*20 = 144,72 (А-час) или 520992 (Кл), что соответствует 520992/96485 = 5,4 моль-эквивалентов любого вещества, выделившегося на электродах.
2)Находим массу раствора после электролиза.
а) исходная масса раствора сульфата меди (II): 250*1,14 = 285 г.
б) число молей CuSO4: 0,8*0,25 = 0,2 моль, что составляет 0,4 моль-экв. Значит, весь сульфат меди подвергся электролизу, и начался электролиз воды (см. уравнение 2).
в) по уравнению 1 находим массу выделившихся веществ из раствора:
2 моль CuSO4 выделяют (128 + 32) г меди и кислорода
0,2 моль « « 16 г« «
г) число моль-экв. разложившейся воды: 5,4 – 0,4 = 5, что составляет 9*5 = 45 г.
д) масса раствора после электролиза: 285 – 16 – 45 = 224 г.
е) в этом растворе образовалось 0,2 моль H2SO4 (см. уравнение 1).
3)При добавлении к раствору после электролиза раствора NaOH идет реакция:
H2SO4 + 2NaOH = Na2SO4 + 2H2O (3)
Количество прилитого NaOH: (100*0,16): 40 = 0,4 моль.
Масса образовавшегося Na2SO4: 0,2*142 = 28,4 г (см. уравнение 3).
Масса образовавшегося раствора: 224 + 100 = 324 г.
Сульфат натрия кристаллизуется в виде Na2SO4*10H2O
Пусть выпало х г кристаллогидрата. Тогда масса оставшегося раствора равна (324 – х) г, а масса сульфата натрия в нём 0,071(324 – х) г.
С другой стороны, масса Na2SO4, оставшегося в растворе, равна 142*(0,2 – х/322).
0,071*(324 – х) = 142*(0,2 – х/322)
х = 14,58 г
Рекомендации к оцениванию:
1) Уравнения реакций по 1 баллу 1∙3 = 3 балла
2) Масса раствора после электролиза 4 балла = 4 балла
3) Состав и масса выпавшего осадка 3 балла = 3 балла
ИТОГО 10 баллов
Класс
1.Один из возможных вариантов:
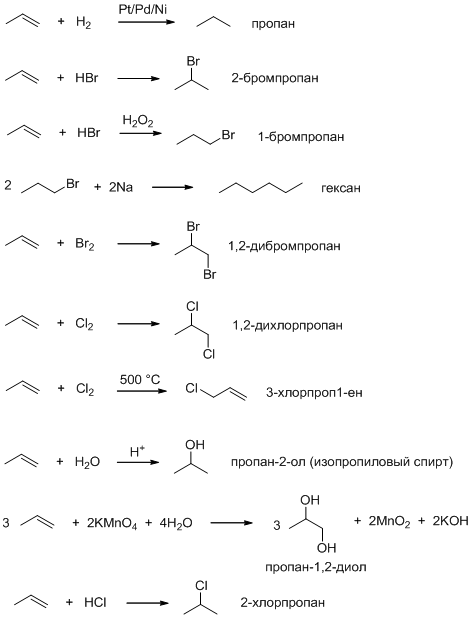
Рекомендации к оцениванию:
1) Правильное уравнение реакции 0,75 балла 0,75·10 = 7,5 баллов
2) Правильное название 0,25 балла 0,25·10 = 2,5 баллов
ИТОГО 10 баллов
2.А – I2, Б – KIO3, В – KI, Г – HI, Д – HIO3, Е – I2O5, Ж – ICl3.
I2 + P + 2H2O = HI + H3PO2
3I2 + 6KOH = KIO3 + 5KI + 3H2O
4KIO3 + 3Na2S2O3 + 3H2O = 4KI + 3Na2SO4 + 3H2SO4
KI + H3PO4 = HI + KH2PO4
I2 +10HNO3(конц.) = 2HIO3 + 10NO2 + 4H2O
2HIO3 = I2O5+ H2O
I2O5 + 5CO = 5CО2 + I2
I2 + KBrO3 + 6HCl = 2ICl3 + KBr + 3H2O
5ICl3+ 9H2O = 3HIO3 + I2 + 15HCl
2KIO3 + 2H2SO4(конц.) = I2O5 + 2KHSO4
8KI + 9H2SO4(конц.) = 4I2+ 8KHSO4 + H2S
2ICl3 + Na2S2O3 + H2O = 2Na2SO4 + 6HCl + 2HI
Рекомендации к оцениванию:
1) Определение элемента Х и веществ А–Ж по 0,5 балла 0,5·8 = 4 балла
2) Уравнения реакций по 0,5 балла 0,5·12 = 6 баллов
ИТОГО 10 баллов
3.В качестве соединений, запись формулы которых аналогична записи формулы тригонометрической функции, можно предложить нитрид кремния (SiNx) или сульфид кобальта (CoSx). Нитриды в природе не встречаются, следовательно, искомый минерал представляет собой сульфид кобальта. Определим индекс:
Cosa = -0,416. Тогда a = 2 радиана
Вещество А– CoS2
Степени окисления – Co+2S-12.
В дальнейшем были проведены следующие реакции:
3CoS2 + 20HNO3 = 3Co(NO3)2 + 6H2SO4 + 14NO + 4H2O
Co(NO3)2 + 2NaOH = Co(OH)2 + 2NaNO3
Co(OH)2 + 2HNO3 = Co(NO3)2 + 2H2O
2Co(NO3)2 + 2LiNO3 = 2LiCoO2 + 6NO2 + O2
В аккумуляторе будут протекать следующие процессы:
Разряд:
Катод: LiCoO2 ® Li1-xCoO2 + xLi+ + xe
Анод: Li+ + e ® Li
При зарядке аккумулятора протекают обратные процессы.
Использование неводных растворителей связано с предотвращением окислительно-восстановительных реакций с участием воды (металлический литий восстанавливает водород из воды, кобальт в высоких степенях окисления способен окислять воду).
Рекомендации к оцениванию:
1) Вещество А 2 балла = 2 балла
2) Определение степеней окисления в А 1 балл = 1 балл
3) Уравнения реакций 3 балла = 3 балла
4) Процесс на катоде 2 балла = 2 балла
5) Процесс на аноде 1 балл = 1 балл
6) Объяснение использования неводных растворителей = 1 балл
ИТОГО 10 баллов
4.m(H2O) = 10,000 – 8,703 = 1,297 г, m(H) из воды = 1,297*2/18 = 0,144 г, m(H)общ. = 10,000*0,0432 = 0,432 г.
В веществе Бесть водород, но это не вода. Возможно, катион аммония, тогда, учитывая большое содержание хлора, вещество Г может быть хлоридом аммония (улетает в виде аммиака и хлороводорода).
m(NH4Cl) = 8,703 – 4,845 = 3,858 г
m(Cl) из NH4Cl = 3,858*35,5/53,5 = 2,56 г
m(Cl) общая = 10,000*0,512 = 5,12 г
m(Cl) в хлориде металла = 5,12 – 2,56 = 2,56 г
m(Me) в хлориде металла = 4,845 - 2,56 = 2,285 г
Для хлорида МеCln справедливо равенство: ν(Cl) = n*ν(Me)
2,56/35,5 = n*2,285/M, где М – молярная масса металла
M = 31,69n, при n = 2 получаем М = 63,38 г/моль, что соответствует меди.
Вещество В – СuCl2.
Для составления формулы кристаллогидрата найдём количества веществ составляющих:
ν(H2O) = 1,297/18 = 0,072 моль
ν(NH4Cl) = 3,858/53,5 = 0,072 моль
ν(СuCl2) = 4,845/134,5 = 0,036 моль
Имеем 2 Н2О, 2 NH4Cl, 1 СuCl2 => формула кристаллогидрата А – (NH4)2[CuCl4]*2H2O
ВеществоБ– (NH4)2[CuCl4]
Рекомендации к оцениванию:
1) Определение веществ В и Гпо 3 балла 2·3 = 6 баллов
2) Определение веществ A и Б по 2 балла 2·2 = 4 балла
ИТОГО 10 баллов
5. 1) H2S = H+ + HS- K1 = [H+]*[HS-]/[H2S]
HS- = H+ + S2- K2 = [H+]*[S2-]/[HS-]
Mg3(PO4)2 ® 3Mg2+ + 2PO43- ПР = [Mg2+]3*[PO43-]2
Ag+ + 2NH3 = Ag(NH3)2+ K = [Ag(NH3)2+]/([Ag+]*[NH3]2)
2) Определим концентрацию ионов водорода в лимане после аварии.
n(HCl) = 10*300000 = 3000000 моль
V = 3000000*3 = 9000000 + 300 = 9000300 м3 = 9000300000 л
[H+] = 3000000/9000300000 = 3,3*10-4 моль/л
Пусть в 1 л воды растворится х моль минерального компонента раковин, т.е. х моль СаСО3. Тогда: ПР = [Ca2+]*[CO32-]. C другой стороны, концентрация ионов кальция равна суммарной концентрации углеродсодержащих частиц, т.е. х = [CO32-] + [HCO3-] + [CO2]
Нетрудно показать, что [CO32-] = К1*К2*x/([H+]2 + [H+]K1 + K1*K2)
В описанной ситуации [CO32-] = 1,91*10-10*х моль/л. Тогда 1,91*10-10х2 = 3,7*10-9, х = 4,4 моль/л. Очевидно, что равновесная концентрация кальция очень высока, следовательно, вся популяция моллюсков погибнет.
При расчете использовались следующие допущения:
А) было принято, что иных источников ионов кальция и карбонат-ионов в лимане нет;
Б) строго говоря, произведение активности должно быть выражено через активности ионов.
В решении считалось, что активности в данном случае равны концентрациям ионов.
Рекомендации к оцениванию:
1) Выражения для констант равновесия по 0,5 балла 0,5∙4 = 2 балла
2) Концентрация Н+ 1 балл = 1 балл
3) Выражение для [CO32-] 3 балла = 3 балла
4) Концентрация карбонат-анионов 2 балла = 2 балла
4) Вывод о популяции моллюсков 0,5 балла = 0,5 балла
5) Допущения 1,5 балла = 1,5 балла
ИТОГО 10 баллов
6. а) Единственный алкен, который мог бы получиться при дегидратации 3,3-диметилбутан-2-ола (без изменения углеродного скелета молекулы) – это 3,3-диметилбут-1-ен (алкен А). Однако Юный химик не учёл, что промежуточно образующийся вторичный карбкатион может перейти в более устойчивый третичный карбкатион путём 1,2-метильного сдвига (перегруппировка Вагнера-Меервейна). В результате образуются алкены с изменённым углеродным скелетом: 2,3-диметилбут-2-ен (алкен Б) и 2,3-диметилбут-1-ен (алкен В).
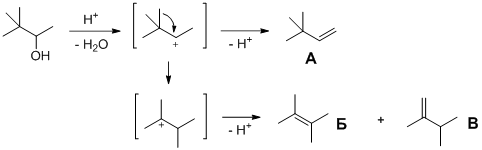
При гидробромировании симметричного алкена Бкак без перекиси, так и в её присутствии образуется один и тот же бромид Г (2-бром-2,3-диметилбутан). При гидробромировании алкена В с несимметрично замещённой двойной связью без перекиси и в её присутствии образуются различные продукты, соответственно, бромид Г и бромид Д(1-бром-2,3-диметилбутан).
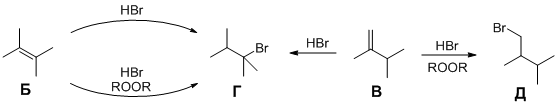
б) По правилу Зайцева в большем количестве образуется более замещённый алкен Б.
в) Один из способов, позволяющий избежать перегруппировок, пиролиз ацетатов:
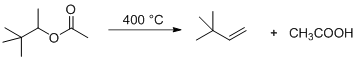
Кроме того, могут быть использованы реакции отщепления в алкилгалогенидах или частичное восстановление 3,3-диметилбут-1-ина:

Рекомендации к оцениванию:
1) Структура A, Г, Д по 1 баллу 1∙3 = 3 балла
2) Структура Б, В по 2 балла 2∙2 = 4 балла
3) Преимущественное образование Б с объяснением 1 балл = 1 балл
3) Способ синтеза А 2 балла = 2 балла
ИТОГО 10 баллов
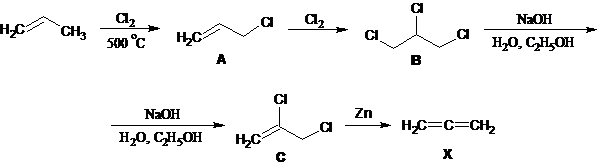
7. 1) Речь идет о кумулированных диенах (алленах), содержащих двойные связи при одном углеродном атоме. Простейший представитель ряда образуется по следующей схеме превращений:
2) В аллене оба крайних атома углерода находятся в sp2-гибридном состоянии, а центральный – sp-гибридизован. Поскольку две p-орбитали центрального атома углерода ортогональны, две π-связи расположены также ортогонально друг другу, т.е. заместители при крайних атомах углерода располагаются во взаимно перпендикулярных плоскостях:
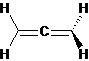
Следовательно, оптической активностью будут обладать такие производные аллена, которые имеют различные заместители при крайних углеродных атомах:

3) Молярная масса образующихся изомерных продуктов составляет 40·2 = 80 г/моль, что в два раза больше молярной массы аллена. С учетом того, что в процессе нагревания никаких дополнительных реагентов не использовали, логично предположить, что произошла реакция димеризации:
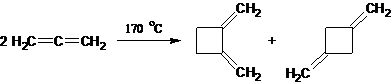
И действительно, нагревание приводит к термической циклодимеризации алленов.
Рекомендации к оцениванию:
1) Структурные формулы A, B, C, X по 1 баллу 1·4 = 4 балла
2) Отнесение к гомологическому ряду алленов 1 балл = 1 балл
3) Объяснение оптической изомерии алленов 1 балл = 1 балл
4) Структурные формулы оптических изомеров по 1 баллу 1·2 = 2 балла
5) Продукты циклодимеризации по 1 баллу 1·2 = 2 балла
ИТОГО 10 баллов
Класс
1. Возможная схема превращений:Cl2 → NaClO → NaClO3 → KClO3 → KClO4 → KCl → HCl → FeCl2 → FeCl3 → CuCl2 → CuCl.
Рекомендации к оцениванию:
1) Уравнения реакий по 1 баллу 1·10 = 10 баллов
ИТОГО 10 баллов
2. 1. У моллюсков и членистоногих за перенос кислорода ответственен медьсодержащий белок гемоцианин – «лазурный пигмент». Болезнь Уилсона-Коновалова – нарушение метаболизма меди, вследствие которого развиваются нарушения ЦНС и некоторых внутренних органов.
При сжигании металла в атмосфере кислорода может образоваться только бинарное соединение этого элемента с кислородом, итак A – окись X. При термическом разложении A образовалось B, также являющееся бинарным соединением X и кислорода.
Массовая доля кислорода в B: ω(О)=100-88,83=11,17%. Если в составе Bn атомов кислорода, то можно рассчитать относительную молярную массу В: Mr(B) = 16n/0,1117 = 143,24n.
Если в B один атом кислорода, то Mr(B) = 143,24, значит относительная молярная масса m атомов X в B: 143,24 – 16 = 127,24. Если m = 1, то X – теллур (что не соответствует расчетным данным), его монооксид TeO известен только в газовой фазе, что не удовлетворяет условию задачи. Если m = 2, то X – медь, что соответствует условию. При сжигании меди в кислороде образуется черный оксид CuO (A), который при разложении превращается в Cu2O (B). При взаимодействии Cu2O с диметилсульфатом получается Cu2SO4 (C) и (CH3)2O (D). При растворении CuO в разбавленной H2SO4 образуется CuSO4 (E). Обрабатывая раствор сульфата меди и хлорида натрия диоксидом серы, можно получить CuCl (F), из которого при взаимодействии с метиллитием получается CuCH3 (G). С ацетиленом метилмедь образует Cu2C2 (H) и CH4 (I). Сухой сульфат меди в смеси с KCl реагирует со фтором с образованием K3[CuF6] (J).
2. В гемоцианине медь находится в виде Cu(I). Чтобы осуществить доставку кислорода его необходимо связать с металлоцентром белка, что достигается путём окислительно-восстановительной реакции. Если бы в «лазурном пигменте» степень окисления меди была равна +2, то при окислении её кислородом воздуха она должна была бы переходить в Cu(III), что невозможно в условиях живого организма.
3. Уравнения реакций:
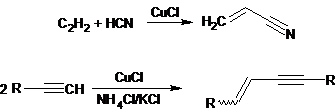
Рекомендации к оцениванию:
1) Уравнения реакций по 1 баллу 1∙8 = 8 баллов
2) Степень окисления X в «лазурном пигменте» 0,5 балла = 0,5 балла
3) Объяснение степени окисления 0,5 балла = 0,5 балла
4) Уравнения реакций катализируемых CuCl по 0,5 балла 0,5∙2 = 1 балл
ИТОГО 10 баллов
3. Из условия задачи следует, что в состав комплекса входит фосфор. Пусть его массовая доля составляет 15,58%. Тогда на второй элемент приходится: 31*78,39/15,58 = 156 г/моль. Рассматривая более легкие элементы, который могут входить в состав лиганда, получаем, что данная масса, скорее всего, может соответствовать 13 атомам углерода. На третий элемент приходится 31*6,03/15,58 = 12 г/моль. Скорее всего, это 12 атомов водорода.
Таким образом, простейшая формула лиганда – РС13Н12. Поскольку по условию двойных и тройных связей в составе соединения нет, наиболее вероятным представляется наличие ароматических фрагментов: Р(С6Н5)2СН2.
Наиболее вероятной истинной формулой представляется [Р(С6Н5)2СН2]2 – этан-1,2-диилбис(дифенилфосфин) (название по ИЮПАК) или 1,2-бис(дифенилфосфино)этан (традиционно употребляемое название). Наличие только одного сигнала в спектре ЯМР указывает на эквивалентность атомов фосфора.
Металл, названный в честь царицы цветов – родий (родос по-гречески – роза). Поскольку массовая доля родия составляет 7,94%, в составе комплекса должны быть три молекулы фосфина. Образующийся комплекс – Rh([Р(С6Н5)2СН2]2)33+ (три[1,2-бис(дифенилфосфино)этан]родий(III)). В наиболее устойчивом изомере лиганд должен быть бидентатным (тогда образуются три 5-членных хелатных цикла). Октаэдрический комплекс RhL3, содержащий бидентатный лиганд, будет обладать оптической активностью; наиболее устойчивыми изомерами будут l и D-изомеры.
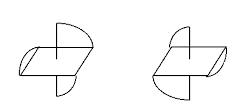
Слева – D-изомер, справа –l-изомер.
Рекомендации к оцениванию:
1) Определение простейшей формулы лиганда 1 балл = 1 балл
2) Истинное строение лиганда 2 балла = 2 балла
3) Название лиганда 1 балл = 1 балл
4) Состав комплекса 1 балл = 1 балл
5) Название комплекса 2 балла = 2 балла
6) Указание на бидентантный характер лиганда 1 балл = 1 балл
7) Оптические изомеры 2 балла = 2 балла
ИТОГО 10 баллов
4. а) Существует 6 изомеров дибромиодбензола
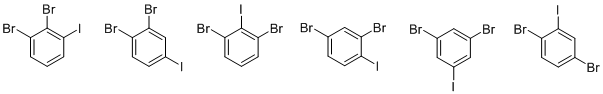
б)
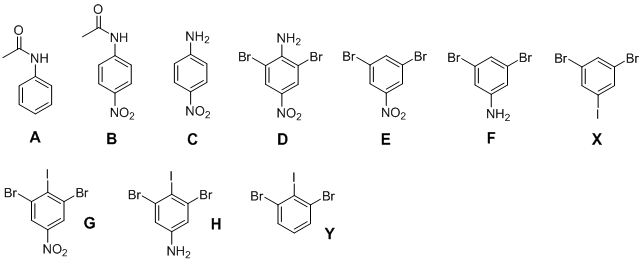
в) – с помощью спектроскопии ядерного магнитного резонанса (в спектре изомера Х будут наблюдаться два синглетных сигнала с соотношением интенсивностей 2:1, в спектре изомера Y – дублетный сигнал и триплетный сигнал с соотношением интенсивностей 2:1)
– с помощью измерения дипольного момента молекул (дипольный момент изомера Y больше, чем изомера Х)
Возможно применение и других методов.
Рекомендации к оцениванию:
1) Структуры изомеров по 0,25 балла 0,25∙6 = 1,5 балла
2) Структуры A, B, C, D по 1 баллу 1∙4 = 4 балла
3) Структуры E, F, G, H, X, Y по 0,5 балла 0,5∙6 = 3 балла
4) Физико-химические методы по 0,5 балла 0,5∙3 = 1,5 балла
ИТОГО 10 баллов
5. Прокаливание калиевой соли карбоновой кислоты с гидроксидом калия («едкое кали») – это лабораторный способ получения алканов (реакция Дюма). При этом в остатке обнаруживается K2CO3. Уравнения реакций:
R1-COOK + KOH = R1-H + K2CO3
R2-COOK + KOH = R2-H + K2CO3
Выделившийся газ – это смесь двух алканов в равных количествах, так как смесь солей эквимолярная. Мср. (газа) = 0,31*29 = 9 г/моль.
0,5*(М1 + М2) = 9; М1 + М2 = 18 г/моль, где М1 и М2 – молекулярные массы алканов.
Очевидно, что один из алканов – метан CH4 (М = 16 г/моль), при этом остаток равен 2 г/моль. То есть второй газ – это не алкан, а водород Н2. Он может быть получен из соли муравьиной кислоты – формиата калия HCOOK. Вторая соль, соответственно, ацетат калия СН3COOK.
Уравнения реакций:
НCOOK + KOH = Н2↑ + K2CO3
СН3COOK + KOH = СН4↑ + K2CO3
Рассчитаем массы солей:
n (HCOOK) = n (СН3COOK) = 0,45/(2*22,4) = 0,01 моль
m (HCOOK) = 0,01*84 = 0,84 г; m (СН3COOK) = 0,01*98 = 0,98 г
При более высокой температуре формиат калия превращается в оксалат калия (соль щавелевой кислоты), а ацетат калия – в ацетон:
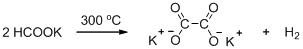
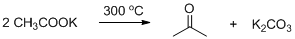
Рекомендации к оцениванию:
1) Определение солей по 2 балла 2∙2 = 4 балла
2) Определение массы каждой соли по 1 баллу 1∙2 = 2 балла
3) Уравнения реакций по 1 баллу 1∙4 = 4 балла
ИТОГО 10 баллов
6.
X 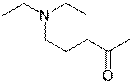 | Y 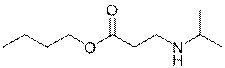 | Z 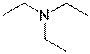 |
| 5-(диэтиламино)пентан-2-он | Бутил-3-(изопропиламино)пропаноат | Триэтиламин |
Формулы можно подтвердить расчетом по массовым долям азота.
Третичные амины (X и Z) взаимодействуют как основания с присоединением протона.
Уравнение реакции для третичных аминов:
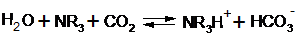
Вещество Y – вторичный амин, который способен образовывать карбаматы, равновесие сдвинуто в сторону растворимой формы сильнее, и поэтому удаление углекислого газа происходит труднее.
Уравнение реакции для вторичных аминов:

Для определения Ka(HХ+) не нужно знать количество вещества и титранта, достаточно указать, что pKa(HХ+) соответствует pH в точке, где количество сопряженной кислоты равно количеству основания (то есть половина эквивалента титранта). pKa(HХ+)= 10.2 (допустимая точность ±0.5).
Другие физические параметры:
- Константа распределения октанол – вода (Kow), которая характеризует гидрофильность вещества, слишком гидрофильное вещество будет смешиваться с водой и без углекислого газа, а слишком гидрофобное не будет и при пропускании CO2.
- Диэлектрическая проницаемость (ε), аналогично Kow.
- Растворимость в воде. Если вещество растворимо в воде в достаточно большом количестве (но при этом не смешивается с ней), то его нельзя использовать, поскольку разделение фаз будет не полным, а значит и очистка будет не полной.
Другие физические характеристики засчитываются, если их использование обосновано.
Основано на статье: Jesse R. Vanderveen, Jeremy Durelle and Philip G. Jessop, «Design and evaluation of switchable-hydrophilicity solvents», Green Chem., 2014, 16, 1187-1197.
Рекомендации к оцениванию:
1) Структурные формулы веществ X, Y, Z по 1 баллу 1∙3 = 3 балла
2) Названия веществ X, Y, Z по 0,5 балла 0,5∙3 = 1,5 балла
3) Уравнения реакций с углекислым газом по 0,5 балла 0,5∙2 = 2 балла
4) Определение константы кислотности сопряженной кислоты 3 балла = 3 балла
5) Физические характеристики по 0,5 балла 0,5∙3 = 1,5 балла
ИТОГО 10 баллов
7. Выясним, что представляет соб<
