Метод электронно-ионного баланса. Направление ОВР
Рассмотрим метод электронно-ионного баланса на примере реакции
K2Cr2O7 + Ti2(SO4)3 + H2SO4 = Cr2(SO4)3 + Ti(SO4)2 + H2O + K2SO4.
Уравнивание стехиометрических коэффициентов ионно-электронным методом проводим по определенному алгоритму.
1) Проставим для всех элементов степени окисления:
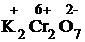 +
+ 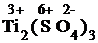 +
+ 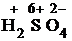 =
= 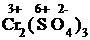 +
+ 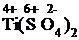 +
+ 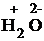 +
+ 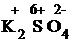 .
.
2) определим элементы, меняющие степень окисления в результате реакции, и выясним, какое вещество является окислителем (принимает электроны), а какое – восстановителем (отдает электроны).
В данной реакции изменяют степени окисления элементы Cr и Ti, при этом K2Cr2O7 выполняет роль окислителя, а Ti2(SO4)3 является восстановителем, H2SO4 играет роль среды.
3) Запишем реакцию в ионно-электронном виде и подчеркнем окислитель и восстановитель. Для этого учитываем диссоциацию молекул на ионы, а слабые электролиты (например, Н2О, оксиды и сульфиды металлов), если они встречаются в реакции, оставляем в молекулярном виде. Получаем:
2K+ + (Cr2O7)2- + 2Ti3+ + 3(SO4)2- + 2H+ + (SO4)2– =
= 2Cr3+ + 3(SO4)2- + Ti4+ + 2(SO4)2- + H2O + 2K+ + (SO4)2- . (1)
4) Представим полуреакции окисления и восстановления, рассматривая только подчеркнутые частицы. Сравниваем количество основных элементов справа и слева и, при необходимости, вводим уравнивающие коэффициенты (в данном случае ставим 2 перед Ti4+).
(Cr2O7)2- → 2Cr3+ ; (2)
окислитель
2Ti3+ → 2Ti4+ . (3)
восстановитель
5)Определимчисло принятых электронов в полуреакции восстановления и число отданных электронов в полуреакции окисления.
(Cr2O7)2- + 6 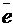
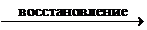 2Cr3+ ; (4)
2Cr3+ ; (4)
2Ti3+ – 2 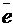
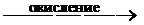 2Ti4+ . (5)
2Ti4+ . (5)
6) Проведем в каждой строчке ионное уравнивание, учитывая изменения состава ионов. Для уравнивания числа атомов кислорода и водорода, вводят в зависимости от среды или молекулы воды и ионы водорода (если среда кислая), или молекулы воды и ионы гидроксида (если среда щелочная).
В нашем случае баланс по кислороду устанавливаем в виде H2O, а по водороду – в виде Н+. В правую часть полуреакции (4) вводим 7 молекул H2O, а в левую часть – добавляем 14∙Н+. В полуреакции (5) изменений нет. Получаем следующее:
14Н+ +(Cr2O7)2- + 6 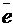 → 2Cr3+ + 7H2O; (6)
→ 2Cr3+ + 7H2O; (6)
2Ti3+ – 2 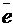 → 2Ti4+ . (7)
→ 2Ti4+ . (7)
7) Установим электронный баланс, принимая во внимание, что число отданных восстановителем электронов всегда равно числу электронов, принятых окислителем. Для этого справа ставим вертикальную черту, находим наименьшее общее кратное (HОК)между количеством отданных и принятых электронов (в данном примере HОК= 6) и проставляем соответствующие коэффициенты.
 14Н+ +(Cr2O7)2- + 6
14Н+ +(Cr2O7)2- + 6 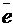 → 2Cr3+ + 7H2O 1
→ 2Cr3+ + 7H2O 1
2Ti3+ – 2 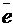 → 2Ti4+ 3
→ 2Ti4+ 3
8) Суммируем левые и правые части полуреакций, умножив на соответствующие коэффициенты:
14H+ + (Cr2O7)2- + 6Ti3+ = 2Cr3+ + 7H2O + 6Ti4+.
9) Теперь под знаком равенства поставим короткую вертикальную черту и для элементов, стоящих слева, добавим связанные с ними частицы, которые раньше мы не учитывали. Как видно из 3, для (Cr2O7)2- это 2К+, для 2Ti3+ это 3(SO4)2-, а для 2Н+ – (SO4)2-. Те же самые частицы записываем справа от черты. Получаем следующее:
14H+ + (Cr2O7)2- + 6Ti3+ = 2Cr3+ + 7H2O + 6Ti4+;
7(SO4)2- + 2K+ + 9(SO4)2- | 7(SO4)2- + 2K+ + 9(SO4)2-.
10)Учитывая добавленные ионы, составляем полное уравнение со всеми стехиометрическими коэффициентами:
K2Cr2O7 +3Ti2(SO4)3 +7H2SO4 = Cr2(SO4)3 +6Ti(SO4)2 + 7H2O+K2SO4.
Теперь определим термодинамическую вероятность протекания данной окислительно-восстановительной реакции. Как показано в теме IV, для этого необходимо провести расчет убыли свободной энергии (ΔG0298 химической реакции).
Записываем из 7 полуреакции окисления и восстановления и, пользуясь табличными данными, приводим для них справа значения электродных потенциалов (φ0):
14Н++(Cr2O7)2- 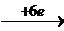 2Cr3++7H2O; φ
2Cr3++7H2O; φ 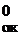 = φ
= φ 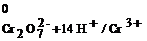 = +1,33 В;
= +1,33 В;
2Ti3+ 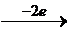 2Ti4+ φ
2Ti4+ φ  = φ
= φ 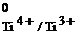 = –0,04 В.
= –0,04 В.
Рассчитываем ЭДС протекающего процесса (E0):
E0 = φ  – φ
– φ  = 1,33 – (-0,04) = 1,37 В.
= 1,33 – (-0,04) = 1,37 В.
Далее рассчитываем ΔG 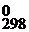 химической реакции:
химической реакции:
ΔG0298 = – zF E 0,
где z – число электронов, переданных от восстановителя к окислителю. С учетом электронного баланса zравно наименьшему общему кратному коэффициентов, для данной ОВР z = 6;
F – число Фарадея, равное 96500 Кл/моль.
Чтобы ответ получить в кДж, вводим множитель 10-3:
ΔG0298 =– zF E 0 = –6×96500×1,37×10-3 = –793,2 кДж.
Так как ΔG0298 < 0, то данная реакция термодинамически вероятна, т.е. может протекать в прямом направлении.
