Энергетика и направление химических процессов
Задача 1.
Определите стандартное изменение энтальпии ∆Н0хр реакции окисления метана.
РЕШЕНИЕ. Запишем термохимическое уравнения реакции окисления метана и выпишем табличные значения стандартных энтальпий образования веществ:
СН4 (г.) + 202 (г.) = С02(г.) + 2Н2О(г.)
∆Н°298, кДж/моль -74,9 0 -393,5 -241,8
В соответствии с 1 следствием из закона Гесса изменение энтальпии процесса равно:
∆Н0хр = ( 2∆Н°(Н2О(г)) + ∆Н°(CO2(г)) ) – ( ∆Н°(CH4(г)) + 2∆Н°(O2(г)) ) =
= ( 2 (-241,8) + (-393,5) ) - ( (-74,9) + 2 ∙ 0 ) = - 802,2 кДж.
Так как энтальпия системы в результате реакции убывает, то реакция идет с выделением тепла и является экзотермической.
Задача 2.
По уравнению Fe3O4(к) + 4H2(г) = 3Fe(к) + 4H2O(г) рассчитать тепловой эффект реакции при получении:
а) 1 кг железа; б) если прореагирует 1 моль H2 ; в) если образуется 1л водяных паров.
РЕШЕНИЕ. Запишем термохимическое уравнения реакции и выпишем табличные значения стандартных энтальпий образования веществ:
Fe3O4(к) + 4H2(г) = 3Fe(к) + 4H2O(г)
∆Н°298, кДж/моль -1118 0 0 -241,8
В соответствии с 1-м следствием из закона Гесса изменение энтальпии процесса равно:
∆Н°хр = 4∙∆Н° (Н2О(г)) – ∆Н° (Fe3O4(к)) = 4 ∙ (-241,8) – (-1118) = 150,8 кДж.
∆Н°хр > 0, следовательно, данная реакция является эндотермической.
а) изменение энтальпии реакции в данном случае рассчитано на 3 моль железа (МFe= 56г/моль) , т.е. на 3 ∙ 56 г = 168 г. Изменение энтальпии при получении 1кг железа определяется из соотношения:
168 г Fe – - 150,8 кДж
1000 г Fe – Х кДж,
Отсюда Х = - 897 кДж.
б) изменение энтальпии реакции в данном случае рассчитано на 4 моль водорода. Изменение энтальпии при участии 1моль водорода определяется из соотношения:
4 моль Н2 – - 150,8 кДж
1 моль Н2 – Х кДж,
Отсюда Х = - 37,7 кДж.
в) изменение энтальпии реакции в данном случае рассчитано на 4 моль водяных паров, т.е. на 4 ∙ 22.4 л = 89,6 л, где Vм = 22,4л/моль. Изменение энтальпии при получении 1л водяного пара определяется из соотношения:
89,6 л Н2О – - 150,8 кДж
1 л Н2О – Х кДж
Отсюда Х = 1,67 кДж.
Задача 3
Определить верхний предел температуры, при которой может протекать процесс образования пероксида бария по реакции
2BaO(к) + O2(г) = 2BaO2(к).
Какой из факторов (энтальпийный или энтропийный) определяют направление самопроизвольного протекания реакции при низких и высоких температурах?
РЕШЕНИЕ. Изменение энтальпии реакции образования пероксида бария имеют ∆Н°хр = 2∆Н°ВаО2 - (2∆Н°ВаО + ∆Н°О2) = -634,7∙2 - (-553,9∙2 + 0) = -161,6 кДж.
Изменение энтропии
∆S°хр =2S°ВаО2 – (2S°ВаО + S°О2) =77,5∙2 – (70,5∙2 + 206) = -191 Дж/К = - 0,191 кДж/К.
Свободная энергия этого процесса выразится уравнением ∆G°хр = ∆Н°хр- Т∆S°хр. При стандартных условиях ∆G°хр = -161,6 + 0,191× 298 = -104,68 кДж. Так как ∆G°хр < 0, реакция при стандартных условиях протекать может.
Температуру инверсии можно найти из соотношения ∆G° = 0. Отсюда следует:
∆G°хр = ∆Н°хр- Т∆S°хр = 0, а Тинв = 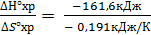 = 846,07 К.
= 846,07 К.
Выше температуры 846,07 К процесс образования BaO2 не может быть реализован.
Из расчетов следует, что ∆Н°хр< 0 и ∆S°хр< 0. При Т < 846,07К ∆G°хр < 0 и, значит, знак ∆G°хр определяется энтальпийным фактором (∆Н°хр< 0). При Т > 846,07К ∆G°хр меняет свой знак на положительный и определяющим становится энтропийный фактор.
Задача 4.
Вычислить изменение энтропии при испарении 250 г воды при 25 °С, если мольная теплота испарения воды (∆Н°исп) при этой температуре равна 44,08 кДж/моль.
РЕШЕНИЕ. Процессы фазовых переходов происходят при условии постоянства свободной энергии Гиббса (∆G°фп = 0). При испарении энтропия вещества возрастает на величину
∆Sисп= 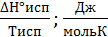 .
.
Количество воды, содержащееся в 250г составляют
ν = 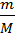 =
= 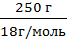 г = 13,88 моль.
г = 13,88 моль.
Отсюда теплота испарения 250 г воды равна:
∆Н°= ν•∆Н°исп = 13,88моль ∙ 44,08 кДж/моль = 611,83кДж = 611830Дж.
Изменение энтропии при испарении 250 г воды при Т=25 + 273 = 298К.
∆Sисп= 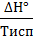 =
= 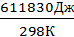 = 2050 Дж/К.
= 2050 Дж/К.
