При термическом разложении 0,542г оксида металла (II) получили 28 мл кислорода (н.у.). Определить металл.
РЕШЕНИЕ: 28 мл = 28∙10-3л. Чтобы определить металл, мы должны определить его молярную массу М=ЭМе∙ В, где В–валентность металла.
Из соотношения m/M = V/VM следует, что
mo = МоVo /VM = 32 г/моль ∙ 28∙10-3л / 22,4л/моль = 0,04 г,
в свою очередь, из закона сохранения массы в химических реакциях следует, что масса оксида металла складывается из массы металла и массы кислорода mMeO = mMe + mo, откуда mMe = mMeO - mo = 0,542г – 0,04г = 0,502 г.
Согласно закону эквивалентов mMe / mO = ЭМе / ЭО ,откуда
ЭМе = mMe∙ЭО / mO = 0,502г ∙ 8 г/моль / 0,04г = 100,4 г/моль.
Значит, Ar=ЭМе∙В = 100,4г/моль ∙ 2 = 200,8 г/моль. Это ртуть.
СТРОЕНИЕ АТОМА
ПРИМЕР I. Напишите электронные формулы элементов №32 и №43. Определите:
1) место элементов в периодической системе (группа, подгруппа, период);
2)распределение валентных электронов по атомным орбиталямв нормальном и возбужденном состоянии, высшую степень окисления;
3) формулу их высших соединений с кислородом и укажите их характер;
4) какой из этих элементов обазует газообразное соединение с водородом и какова формула этого соединения;
Какие квантовые числа характеризуют их валентные электроны.
РЕШЕНИЕ. Порядковый номер элемента соответствует заряду его атома и, следовательно, количеству электронов в атоме. Зная порядок заполнения атомных орбиталей и максимальную емкость каждого квантового подуровня, можем записать электронную формулу атома.
Элемент №32 :
Электронная формула1s22s22p63s23p63d104s24p2
Внешним у этого элемента является четвертый квантовый уровень (n=4), поэтому он расположен в 4-м периоде. Количество электронов на внешнем квантовом
уровне равно 4, значит, он находится в 4-й группе, и так как это р-элемент (ℓ=1) – в главной подгруппе. Магнитное квантовое число для электронов, завершающих электронную формулу, может принимать любое из значений: -1, 0, 1. Распределение валентных электронов по атомным орбиталям в основном и возбужденном состоянии следующее:
4s 4p 4s 4p
Cуммарный спин в основном cостоянии ∑S=1.
Высшая положительная степень окисления этого элемента равна +4, а высшая отрицательная степень окисления -4. Его высшее соединение с кислородом имеет формулу ЭО2 (GeO2) и обладает амфотерными свойствами. С водородом элемент дает газообразное соединение состава GeH4.
Элемент № 43 имеет электронную формулу:
1s22s22p63s23p63d104s24p64d55s2
Внешним у него является пятый квантовый уровень (n=5), поэтому он расположен в 5 – м периоде, в 7 – й группе, так как сумма электронов на внешнем 5s подуровне и незавершенном 4d подуровне равна 7, и так как это d элемент в побочной подгруппе (ℓ=2) . Магнитное квантовое число для электронов, завершающих электронную формулу, может принимать значения: -2, -1, 0, 1, 2.
Распределение валентных электронов по атомным орбиталям в основном и возбужденном состоянии следующее:
4d 5s
Cуммарный спин в основном состоянии ∑S=2,5.
4d 5s 5p
Максимальная положительная степень окисления этого элемента +7. Его высшее соединение с кислородом имеет формулу Э2O7 (Тс2О7).
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Задача 1.
Расположите следующие молекулы в порядке усиления полярности связи: CsF, CaCl2, NaI, ClF, CO, HF, HCl, BeF2, MgF2. В какой из молекул наиболее ярко выражен ионный характер связи?
РЕШЕНИЕ. О степени полярности ковалентной связи А – В можно судить по разности электроотрицательностей элементов:
D ЭО = ЭО (В) – ЭО (А)
где ЭО (А) и ЭО(В) – соответствующие величины относительных электроотрицательностей алементов А и В (шкала электроотрицательностей по Полингу).
Молекула CsF CaCl2 NaI ClF CO HF HCl BeF2 MgF2.
D Э.О 3,3 2,0 1,7 1,0 1,0 1,9 0,9 2,5 1,8
С увеличением разности электроотрицательностей элементов растет степень ионности. Путем сопоставления значений D ЭО располагаем молекулы в порядке усиления полярности связи (ионности) в следующий ряд:
HCl < ClF = CO < NaI < MgF2 < HF < CaCl2 < BeF2 < CsF
Наиболее ярко инный характер связи выражен в молекуле CsF, имеющей наибольшее значение D ЭО
Задача 2.
Оцените валентные возможности элементов второго периода. Какие из этих элементов могут участвовать в образовании связей по донорно-акцепторному механизму в качестве донора и какие – в качестве акцептора?
РЕШЕНИЕ. В образовании химической связи у элементов второго периода могут участвовать 4 валентные орбитали ( одна s- и три р-орбитали), поэтому максимальная ковалентность этих элементов может достигать четырех.
Атом 3Li1s22s1
2p
2s
может образовать одну связь по обменному механизму за счет неспаренного электрона и три связи по донорно-акцепторному механизму (три свободные орбитали), выступая в качестве акцептора.
Возбужденный атом бериллия 4Ве* 1s22s12p1
2s 2p
может образовать две связи по обменному механизму (два неспаренных электрона) и две связи по донорно-акцепторному, выступая в качестве акцептора (две свободные орбитали), например образование иона [BeF4]2- :
BeF2 + 2F- = [BeF4]2-
Возбужденный атом бора 5В*1s22s12p2 может образовать три связи по обменному механизму три неспаренных электрона) и одну связь по донорно-акцепторному механизму в качестве акцептора (одна свободная орбиталь). Например, в ионе [BF4]-.
BF3 + F- = [BF4]-
Невозбужденный атом углерода 6С1s22s22p2
2s 2p
(например в молекуле СО) может образовать две связи по обменному механизму и одну связь по донорно-акцепторному, предоставляя свободную 2р орбиталь, на которой располагается неподеленная электронная пара кислорода.
Возбужденный атом углерода 6С* 1s22s12p3
2s 2p
проявляет ковалентность, равную 4, и донорно-акцепторных связей не образует.
Атом азота 7N 1s22s22p3
2s 2p
является потенциальным донором электронов за счет неподеленной электронной пары, расположенной на s – орбитали. В ионе NH4+ ковалентность азота равна 4 (три связи образованы по обменному и одна связь по донорно-акцепторному механизму:
:NH3 + H+ = NH4+
Атом кислорода 8О 1s22s22p4
2s 2p
способен образовать две связи по обменному механизму и предоставить двухэлектронную орбиталь, выступив в качестве донора. Например, в ионе Н3О+.
В связи с увеличением заряда ядра и уменьшением радиуса атомов (при движении по периоду слева направо) донорные свойства ослабевают (электронные пары сильнее удерживаются атомом). Атом кислорода может предоставить из двух неподеленных пар только одну, атом фтора и тем более атом неона практически не образуют связей по донорно-акцепторному механизму.
Ион 9F- 1s22s22p6
2s 2p
при образовании комплексных анионов выступает в качестве донора.
Валентные возможности элементов третьего и последующих периодов повышаются за счет наличия d-валентных орбиталей, которые могут участвовать в образовании связей по донорно-акцепторному механизму.
Как правило, максимальная ковалентность элементов третьего периода равна шести. Валентные d-орбитали либо участвуют в гибридизации с s- и р-орбиталями, давая добавочные s-связи, либо порождают p -связи. Увеличение числа s-связей соответствует повышению координационного числа центрального атома.
Задача 4.
На основании теории гибридизации определить тип гибридизации валентных орбиталей центрального атома и пространственную конфигурацию следующих молекул и ионов: BeCl2, BF3, CO2. Полярными или неполярными являются молекулы?
РЕШЕНИЕ.
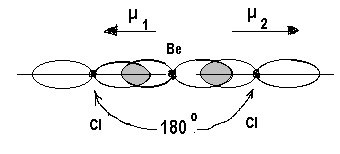
Молекула BeCl2. Электронные формулы и распределение валентных электронов по атомным орбиталям для атомов бериллия и хлора можно представить следующим образом:
4Ве…..2s2 17Cl… 3s23p5
Для образования двух s-связей (по числу атомов хлора) атом бериллия переходит в возбужденное состояние:
4Ве* - 2s12p1
Все валентные электроны бериллия используются для образования s-связей, орбиталей с несвязывающими электронами нет: Cl  Be
Be  Cl
Cl
Комбинация одной s – и одной р-орбиталей приводит к образованию двух гибридных орбиталей, расположенных под углом 1800. Атом бериллия находится в состоянии sp-гибридизации, а молекула BeCl2 имеет линейную структуру. Дипольные моменты связей направлены в противоположные стороны, равны по величине и, следовательно, компенсируют друг друга. Суммарный дипольный момент равен нулю, и молекула, в целом, неполярна.
Схема перекрывания электронных облаков:
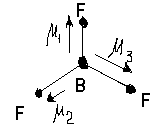
Молекула BF3 . Электронная формула атома бора 5B - 2s22p1. При образовании трех s-связей атом бора переходит в возбужденное состояние
5B* - 2s12p2
Все валентные электроны бора используются на образование s-связей, несвязывающих электронов нет. Атом бора находится в состоянии sp2- гибридизации. Молекула имеет пространственную форму треугольника с валентным углом равным 1200. Суммарный дипольный момент молекулы равен нулю, молекула неполярна
Молекула СО2 . Атом углерода образует четыре ковалентные связи с атомами кислорода: две s- и две p -связи.
p p
О  С
С  О
О
s s
Для образования четырех связей по обменному механизму атом углерода переходит в возбужденное состояние:
6С* - 2s12p3
Электронная формула валентных орбиталей кислорода
8О – 2s22p4
В образовании s-связей участвуют одна s- и одна р-орбиталь атома углерода, т.е. имеет место sp- гибридизация валентных орбиталей.
Не задействованные в образовании s-связей две одноэлектронные р-орбитали углерода не участвуют в гибридизации («чистые» орбиталии ) и образуют две p -связи с р-электронами атомов кислорода. Молекула СО2 имеет линейную структуру, валентный угол равен 1800, дипольный момент молекулы равен нулю. μ1 μ2
О 
Задача 6.
На основании метода локализованных электронных пар определить пространственную конфигурацию молекул СН4; NH3; H2O. Объясните характер изменения валентных углов НЭО в ряду СН4 (109,50), NH3 (107,30), H2O (104,50). Каким типом гибридизации описывается пространственная конфигурация этих молекул? Полярны или неполярны эти молекулы? Рассмотрите конфигурацию этих молекул с позиции теории гибридизации. Объясните влияние неподеленной электронной пары на пространственную конфигурацию этих молекул.
РЕШЕНИЕ. Последовательность действий для предсказания геометрии молекул на основании теории локализованных электронных пар следующая:
1.Подсчитывают число валентных электронов молекулы или иона и записывают электронную валентную структуру (льюисову структуру);
2.По валентной структуре определяют число s-связывающих и несвязывающих электронных пар, т.е. тип молекулы ABnEm (n – число s - связей, m – число несвязывающих электронных пар);
3. По числу локализованных s - электронных пар и типу молекулы предсказывают пространственную конфигурацию молекулы и тип гибридизации, описывающий эту пространственную конфигурацию (с помощью табл.2).
В молекулах СН4; NH3; H2O по восемь валентных электронов ( СН4 – 4+4, NH3 – 5+3, H2O – 6+2), которые образуют по четыре s - связывающие и несвязывающие электронные пары вокруг центрального атома.
Электронные (льюисовы) структуры для этих молекул имеют вид:
Н · · · ·
Н N H H O H
H C H · ·
H
H
Вокруг атома углерода локализовано четыре s-связывающие электронные пары (по числу атомов водорода), вокруг атома азота три s-связывающие электронные пары (по числу атомов водорода) и одна несвзывающая электронная пара, вокруг атома кислорода – две s - связывающие и две несвязывающие электронные пары. Данные молекулы относятся к типу АВ4 (СН4), АВ3Е (NH3), АВ2Е2 (H2O), что соответствует sp3- гибридизации. Молекула метана имеет форму правильного тетраэдра с атомом углерода в центре. В молекуле аммиака одна из вершин тетраэдра занята несвязывающей электронной парой, поэтому молекула имеет форму тригональной пирамиды. В молекуле воды две вершины тетраэдра заняты электронными парами, а сама молекула имеет угловую форму.
Увеличение числа несвязывающих электронных пар центрального атома, отталкивание между которыми проявляется в большей степени, приводит к уменьшению валентного угла НЭН в ряду этих молекул.
Рассмотрим пространственную конфигурацию этих молекул в рамках теории гибридизации.
Валентные электроны центральных атомов C, N и О распределены по атомным орбиталям следующим образом:
6C ….2s22p2
6С*....2s12p3. – возбужденное состояние
7N …..2s22p3
8O …..2s22p4
Молекула СН4.У атома углерода на четырехвалентных орбиталях расположены 4 электрона, которые образуют 4 s - связи с атомами водорода. Комбинация одной s – и трех р-орбиталей приводит к sp3 гибридизации. Молекула имеет форму правильного тетраэдра, к вершинам которого и направлены гибридные орбитали. Валентный угол НСН равен 109028`. Симметричная молекула СН4 имеет дипольный момент, равный нулю (неполярна), так как векторная сумма дипольных моментов четырех полярных s - связей равна нулю.
Молекула NH3. У азота на четырех валентных орбиталях находятся 5 электронов, которые образуют три s - связи с атомами водорода. Одна пара электронов оказывается несвязывающей. Тип гибридизации sp3, но одна из вершин тетраэдра занята несвязывающей электронной парой, поэтому молекула NH3 имеет форму тригональной пирамиды. Валентный угол HNH равен 10703`. Векторная сумма дипольных моментов связей не равна нулю, молекула полярна.
Молекула H2O. У кислорода в молекуле H2O на четырех валентных орбиталях располагаются 6 электронов, которые образуют 2s - связи с атомами водорода и две несвязывающие пары электронов.Тип гибридизации sp3.
Две вершины тетраэдра заняты несвязывающими электронными парами, поэтому молекула H2O имеет угловую форму. Валентный угол НОН равен 10405`. Векторная сумма дипольных моментов связей не равна нулю, молекула полярна.
С позиций теории гибридизации уменьшение валентного угла НЭН объясняется увеличением по периоду энергетического различия между 2s- и 2р – орбиталями и уменьшением вклада 2s – орбиталей при гибридизации с 2р – орбиталями. Это приводит к уменьшению валентного угла и приближению его к 900.
