В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквивалентные массы металла и его оксида.
5. К раствору, содержащему нитрат серебра AgNO3 массой 25,5 г, прилили раствор, содержащий сульфид натрия Na2S массой 7,8 г. Какая масса осадка образуется при этом?
6.Определите число протонов и электронов в атомах железа и ртути.
7. Напишите электронную и графическую конфигурации атома ванадия. Определите к какому семейству он относится.
8. Определить валентностьэлементов в соединении и изобразите его графическую формулу: Cl2O7.
9.Хлорид магния массой 5 г растворили в 300 мл воды. Плотность воды принять равной 1 г/мл. Определить массовую долю растворенного вещества.
10. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
Mg + HCl = МgCl2 + H2
Вопросы
1.Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 4.
2.Плазменное состояние вещества.
Вариант 5
Задачи
1. Определите молярную массу хлорида натрозила NOCl.
2. Какова масса одной молекулы азотной кислоты.
3. Относительная плотность газа по воздуху равна 1,31. Его объем равен 168 л. Определить массу газа при н.у.
4. Определить простейшую формулу соединения, имеющего состав в массовых долях: медь – 34,6 %; железо – 30,4 %; сера – 35,0%.
5. Сколько граммов серы сгорело, если в результатереакцииполучили 5,6 л оксида серы (IV) SO2 (н. у.)? Сколько литров кислорода (н. у.) вступило в реакцию?
6. Закончить уравнение ядерной реакции: 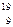 F +
F + 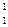 р ® … + g
р ® … + g
7. Напишите электронную и графическую конфигурации атома вольфрама. Определите к какому семейству он относится.
8. Определить валентностьэлементов в соединении и изобразите его графическую формулу: FеС13.
9. Провели реакцию железа с 600 мл соляной кислоты с массовой долей хлороводорода в растворе 20% (r = 1,098 г/мл). Какое количество вещества соли (хлорида железа (II)) получено в реакции?
10. Какова масса вступившего в реакцию железа? Каков объем выделившегося газа (н.у.)? Условия см. в №9.
Вопросы
1.Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 5.
2. Твердые растворы (растворы замещения и внедрения).
Вариант 6
Задачи
1.Вычислите относительную молекулярную массу цианида калия KCN.
2.Определите сколько атомов углерода содержится в 5 г угольной кислоты.
3. Сколько атомов азота содержится в 17 л аммиака (н.у.)?
4.Найти молекулярную формулу вещества, содержащей (по массе) 54,5 % углерода, 36,4 % кислорода и 9,1 % водорода, зная, что плотность его паров по водороду равна 44.
5. Сколько литров водорода (н. у.) образуется при взаимодействии 13 г цинка с избытком хлороводородной кислоты НС1?
6. Сколько нейтронов содержит ядро изотопа хлора 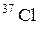 ?
?
7. Напишите электронную и графическую конфигурации атома скандия. Определите к какому семейству он относится.
8. Определить валентностьэлементов в соединении и изобразите его графическую формулу: Сu2О.
9. В 1000 г воды растворили 2 моль хлорида калия. Рассчитайте массовую долю растворенного вещества.
10. Какой объем и какое количество вещества водорода (н.у.) получится при реакции цинка с 60 мл раствора соляной кислоты с массовой долей хлороводорода 20% (r = 1,098 г/мл)?
Вопросы
1.Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 6.
2. Изотопы, изобары, изотоны.
Вариант 7
Задачи
1.Определите относительную молекулярную массу томасовского шлака Ca3(PO4)3 × CaO.
2.Определите число атомов железа в 8,85 г карбоната железа (II).
3. Определите число молекул оксида серы (IV), который занимает объем 2,8 л (н. у.).
