Электронные конфигурации молекул
Образование химической связи можно записать через электронные конфигурации атомов и молекул. Электронные конфигурации молекул записываются через обозначения МО. Например, образование химической связи в двухатомной молекуле лития может быть представлено через электронные конфигурации атомов и молекулы лития:
2 Li [1s2 2s1] ® Li2 [(σ 1s ) 2 (σ* 1s) 2 (σ 2s) 2].
Так как энергии σ 1s и σ* 1s взаимно компенсируют друг друга, то они не участвуют в образовании химической связи и называются внутренними несвязывающими МО, поэтому в сокращенной записи могут либо не записываться, либо иметь условное обозначение, например К. Соответственно сокращенная электронная конфигурация молекулы Li2 имеет формулу Li2 [К1 (σ 2s) 2 ] , молекулы Na2 – Na2 [К2 (σ 3s) 2 ] , молекулы Br2 – Br2 [К1 (σ 2s ) 2 (σ* 2s) 2 (π 2pУ) 2], молекулы N2 – N 2 [К1 (σ 2s ) 2 (σ* 2s) 2 (π 2pУ) 2 (π 2pZ) 2 (σ 2pX) 2 ] .
Образование химической связи в молекуле водорода можно представить электронными конфигурациями:
2 Н [1s1] ® Н2 [(σ 1s ) 2].
В соответствии с энергетической диаграммой (рис. 4.14) при образовании связи два 1s- электрона окажутся на σ 1s-молекулярной орбитали, а σ* 1s-орбиталь будет незаполненной. Соответствующий порядок связи равен 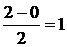 . Молекулярный водород диамагнитен.
. Молекулярный водород диамагнитен.
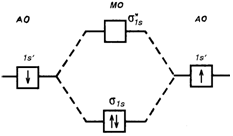 |
Рис. 4.13. Энергетическая диаграмма АО атомов водорода и МО молекул водорода.
При взаимодействии атома и положительно заряженного иона водорода образуется молекулярный ион Н2+: Н [1s1] + Н+ [1s0] ® Н2+ [(σ 1s)1]. Порядок связи МО равен 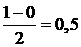 , длина связи у молекулы Н2 меньше, а энергия связи больше, чем у молекулярного иона Н2+ .
, длина связи у молекулы Н2 меньше, а энергия связи больше, чем у молекулярного иона Н2+ .
Метод МО указывает на возможность образования отрицательно заряженного молекулярного иона Н2–: Н [1s1] + Н– [1s 2] ® Н2– [(σ 1s ) 2 (σ* 1s ) 1].
Методы ВС и МО не исключают, а взаимно дополняют друг друга. Метод ВС позволяет объяснить химические связи и свойства многих соединений. Метод МО обеспечивает общий подход ко всем типам химических соединений.
Металлическая связь
Атомы большинства металлов на внешнем энергетическом уровне содержат один, два и реже три электрона. Из-за низкой энергии ионизации электроны в металле могут, отрываясь от атома переходить в межатомное пространство, становясь общими.
Межмолекулярное взаимодействие
Ван-дер-Ваальсовы силы
Межмолекулярное взаимодействие обусловлено Ван-дер-Ваальсовыми силами (электростатическими). Оно является значительно более слабым, чем химическая связь. Полярные молекулы (диполи) взаимодействуют противоположными полюсами, образуя ассоциаты. Диполи могут воздействовать на неполярные молекулы, превращая их в индуцированные (наведенные) диполи. Флуктуации электрической плотности в молекулах, ведут к появлению мгновенных диполей, которые, в свою очередь, индуцируют мгновенные диполи у соседних молекул. В результате взаимодействия мгновенных диполей энергия системы понижается.
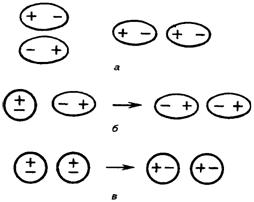
Рис. 4.14. Ван-дер-Ваальсовы взаимодействия молекул: а – диполь-дипольное (ориентационное); б – дисперсионное; в – индукционное взаимодействие
Сжижение газов происходит благодаря возрастанию сил межмолекулярного взаимодействия при повышении давления и понижении температуры.
Водородная связь
Водородная связь возникает между молекулами, имеющими в своем составе атомы водорода и атом сильно электроотрицательного элемента (например, азота, кислорода, фтора). Образование водородной связи обусловлено тем, что в полярных молекулах или полярных группах поляризованный атом водорода имеет очень малый размер, у него отсутствуют внутренние электронные оболочеки, электронная пара связи сдвинута к более электроотрицательному атому. Поэтому водород способен внедряться в электронную оболочку отрицательно поляризованного атома соседней молекулы.
Водородные связи могут возникать как между одинаковыми молекулами F-H ××× F-H , так и разными, как при взаимодействии воды и фтороводорода: Н2О…НF.
Энергия водородной связи возрастает с увеличением ЭО и уменьшением радиуса атомов неметалла. Энергия связи (кДж/моль) приведена в ряду:
–H ××× F − (25 - 42); –Н ××× О< (13-19); –Н ××× N ≡ (8-21) .
Несмотря на высокую ЭО, у хлора водородная связь –H×××Cl– относительно слабая из-за большого размера атома хлора.
Как видно, энергия водородной связи ниже энергии ковалентной связи, а длина больше. Так, у воды длина связи О–Н - 0,096 нм, а связи О×××Н - 0,177 нм.
При возникновении водородных связей образуются димеры, тримеры или полимерные структуры. Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температуры кипения и плавления, теплоты плавления и парообразования.
Водородная связь может также возникнуть между атомами водорода и отрицательными атомами полярных групп в одной и той же молекуле. Например в белках, у которых спиральные полимерные структуры объединяются связями =N-H ××× О<. Спирали нуклеиновых кислот также соединяются между собой водородными связями.
