Донорно-акцепторный механизм
Четвертая ковалентная связь в ионе аммония образуется по донорно-акцепторному механизму. В образовании связи участвует неподеленноая пара электронов одного атома (донора) и вакантная орбиталь другого атома или иона (акцептора).
Азот молекулы аммиака, образует три ковалентные связи с тремя атомами водорода по обменному механизму. У него имеется неподеленная электронная пара, которая может взаимодействовать со свободной орбиталью иона водорода Н+, образуя четвертую ковалентную связь:
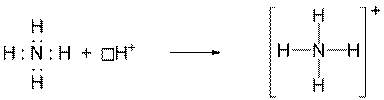 .
.
Четвертая ковалентная связь, образованная по донорно-акцепторному механизму, характеризуется теми же параметрами, что и остальные три ковалентные связи, образованные по обменному механизму.
Насыщаемость – свойство ковалентной связи
Под насыщаемостью ковалентной связи понимается способность атомов участвовать в образовании ограниченного числа ковалентных связей. В ионе аммония азот проявляет ковалентность равную IV. Максимальная ковалентность атомов определяется числом валентных одноэлектронных облаков (для образования связей по обменному механизму), а также числом свободных валентных орбиталей и двухэлектронных облаков (для образования связей по донорно-акцепторному механизму). Атомы элементов одного периода обладают одинаковой максимальной ковалентностью.
Ионная химическая связь
Ионная химическая связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Ионы могут быть простыми, состоящими из одного атома (K+, Na+, F–, Cl–) и сложными (NH4+, SO42–). Поскольку энергия ионизации больше энергии сродства к электрону, то полного отрыва и перехода электрона не происходит даже у пары атомов с большой разностью ЭО, как у щелочных металлов и галогенов. Поэтому чисто ионная связь не существует. Можно лишь говорить о доле ионности связи.
Образование многозарядных ионов (например О2–, N3–) энергетически невыгодно из-за того, что второй и последующий электроны должны присоединяться к уже отрицательно заряженной частице. Вместе с тем, многозарядные сложные ионы (РО43–, SO42–) могут быть устойчивы, т.к. избыточные электроны распределены между несколькими атомами, так что эффективный заряд каждого атома меньше заряда электрона.
Так как электрическое поле иона имеет сферический характер, то для ионной химической связи не характерна направленность. Взаимодействие между ионами осуществляется одинаково независимо от направления. Два разноименных иона, притянувшись друг к другу, сохраняют способность электростатически взаимодействовать с другими ионами. Поэтому к данному иону может присоединяться различное число ионов противоположного знака. Таким образом, ионной связи также не свойственна насыщаемость. Число присоединенных ионов зависит от их зарядов и соотношений геометрических размеров. Ионная химическая связь имеет место в твердых веществах с ионной кристаллической решеткой.
Метод валентных связей
Изложенное выше описание химических связей основано на методе валентных связей (ВС), предложенном в 1927 г. немецкими учеными В. Гейтлером и Ф. Лондоном, которые провели квантово-механический расчет молекулы водорода. Позднее метод ВС получил дальнейшее развитие и был распространен на другие молекулы. Метод ВС обладает многими достоинствами. Он относительно прост и нагляден и позволяет предсказывать многие свойства молекул, такие как пространственная конфигурация, полярность, энергия и длина связей и др. Однако свойства некоторых молекул и ионов метод ВС объяснить не в состоянии. Этод метод предполагает, что атомы в молекуле сохраняют свою индивидуальность, однако электронная структура молекулы значительно отличается от электронной структуры образующих ее атомов. В методе ВС постулируется участие в образовании связей пары электронов, в то же время существуют свободные радикалы, молекулярные ионы, такие как H2+, Не2+, O2–, которые имеют неспаренные электроны. О наличии неспаренных электронов можно судить по магнитным свойствам веществ. Вещества, имеющие неспаренные электроны, парамагнитны, т.е. втягиваются в магнитное поле. Вещества, не имеющие неспаренных электронов, диамагнитны, т.е. выталкиваются из магнитного поля. Согласно методу ВС молекула кислорода не имеет неспаренных электронов, между тем кислород парамагнитен.
Более общим является метод молекулярных орбиталей (МО), позволяющий объяснить ряд явлений и фактов, непонятных с точки зрения метода ВС.
