Электронные конфигурации элементов
История развития представлений о строении атома. Составные части атома: ядро, электроны. Атомные спектры. Квантование энергии электронов в атоме. Уравнение Планка. Планетарная модель атома Резерфорда. Модель атома Н.Бора. Постулаты Бора. Недостатки теории Бора–Зоммерфельда. Двойственная природа микрообъектов. Квантовомеханическая модель атома. Принцип неопределенностей Гейзенберга. Уравнение де Бройля. Представление о волновой функции. Физический смысл волновой функции. Квантовые числа как характеристика состояния электрона в атоме. Значение главного, побочного, магнитного и спинового квантовых чисел. Атомные s-, p-, d-, f-орбитали, наглядное изображение орбитали – электронное облако. Форма s-, p-, d-орбиталей и их направленность.
Представление об электронном энергетическом слое (уровне), подслое (подуровне). Принцип Паули и емкость электронных слоев. Принцип наименьшей энергии, правила Клечковского. Порядок заполнения электронами атомных орбиталей. Электронные конфигурации (формулы) элементов; s-, p-, d-, f-элементы. Правило Хунда. Электронно-графические конфигурации (формулы) элементов в основном и возбужденном состояниях. Краткие электронные паспорта.
Вопросы и задачи: 3, с. 340, № 1, 3, 8–10, 12, 13, 15, 18, 19, 23, 26, 31–33, 37.
Литература: 1, с. 16–45; 2,с. 10–56; 3, с. 324–340; 5, с. 304–332.
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Метод валентных связей (ВС). Основные положения метода ВС. Кривая потенциальной энергии взаимодействия атомов и ионов при образовании молекул. Количественные характеристики химической связи: длина связи, валентный угол, энергия связи. Спинвалентный и донорно-акцепторный механизмы образования ковалентной связи. Донор, акцептор. Координационное число. Валентные возможности элементов 2-го и 3-го периодов в основном и возбужденном состояниях. Представление о σ- и π-связях в двухатомных молекулах, кратность связи. Схема перекрывания атомных орбиталей в молекулах H2, N2. Свойства ковалентной связи: насыщаемость, направленность, поляризуемость. Представление о гибридизации атомных орбиталей. Условия устойчивой гибридизации. Типы гибридизации орбиталей (sp, sp2, sp3, sp3d2), направленность и форма гибридных орбиталей. Строение молекул BeCl2, BF3, CCl4, SF6 с позиций метода ВС. Схема перекрывания атомных орбиталей в молекулах. Локализованные и делокализованные (сопряженные) связи.
Объяснение химической связи в комплексных соединениях с позиций метода валентных связей.
Теория кристаллического поля. Схемы расщепления энергетических уровней d-электронов в октаэдрическом и тетраэдрическом окружении. Спектрохимический ряд лигандов.
Ионная связь как крайний случай поляризации ковалентной связи. Ненаправленность и ненасыщаемость ионной связи.
Межмолекулярное взаимодействие. Водородная связь на примере молекул фтористого водорода, воды, аммиака.
Вопросы и задачи: 6, с. 91, № 293, 294, 296, 297; с. 99, № 299, 301, 304.
Метод молекулярных орбиталей. Молекулярные орбитали как линейная комбинация атомных орбиталей.
Представление о связывающих и разрыхляющих молекулярных орбиталях, σ- и π-молекулярных орбиталях. Основные положения метода молекулярных орбиталей. Энергетические диаграммы двухатомных гомосоединений элементов I и II периодов. Принцип наименьшей энергии, принцип Паули, правило Хунда в применении к молекулам гомосоединений элементов I и II периодов. Порядок связи в рамках метода МО. Описание строения молекул и молекулярных ионов H2, H2+, B2, O2, O2+, O2–, O22–. Объяснение магнитных свойств, энергии, длины и порядка связи в ряду O2, O2+, O2–, O22–. Строение молекул СО и NO с позиций метода МО.
Вопросы и задачи: 6, с. 103, № 307–312, 315.
Литература: 1, с. 46–107; 2, с. 56–118; 5, с. 376–460; 6, с. 82–104.
СВОЙСТВА ВОДОРОДА
Водород. Особое положение водорода в периодической системе. Нахождение водорода в природе. Строение молекулы водорода и молекулярного иона Н 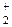 в рамках методов ВС и МО.
в рамках методов ВС и МО.
Промышленные и лабораторные способы получения водорода.
Химические свойства водорода: отношение к кислороду, металлам, неметаллам, оксидам. Окислительные и восстановительные свойства водорода.
Гидриды, способы получения, свойства. Классификация гидридов по типу химической связи – ионные и ковалентные гидриды. Гидролиз гидридов. Объяснение восстановительных свойств иона Н–. Металлические гидриды. Характер связи в гидридах d- и f-элементов. Получение металлических гидридов.
Характеристика водородных соединений неметаллов. Водородная связь на примере соединений HF, NH3, H2O.
Вопросы и задачи:
1. При растворении в 1 л воды 450 л НСl (н.у.) получили раствор с r = 1,21 г/см3. Вычислить молярную концентрацию и массовую долю HCl в растворе.
(Ответ: С = 14 моль/л; ω = 42,3%)
2. Сравнить ∆G 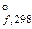 образования водородных соединений ЭН4 элементов IV группы (Э – C, Si, Ge, Sn). Какое из этих соединений устойчивее при 298 К?
образования водородных соединений ЭН4 элементов IV группы (Э – C, Si, Ge, Sn). Какое из этих соединений устойчивее при 298 К?
3. Константа равновесия процесса (H2) + (Br2) ↔ 2 (HBr) составляет при некоторой температуре 0,5. Определить выход HBr в % по объему, если исходные вещества были взяты в количествах 5 моль/л и 3 моль/л соответственно.
(Ответ: η = 33,3%)
4. Найти концентрацию ионов водорода и рН раствора, в котором массовая доля НС1 составляет 0,01%. Какая масса Н+ содержится в 5 л такого раствора?
(Ответ: С = 0,027 моль/л; рН = 2,56; m = 0,0137 г)
5. Какова должна быть минимальная концентрация HI, чтобы прибавление к его раствору равного объема 0,002 н. раствора AgNO3 вызвало появление осадка AgI?
(Ответ: С = 3.10-13 моль/л)
6. Вычислить степень гидролиза, константу гидролиза и рН 0,02 М раствора формиата натрия.
(Ответ: β = 5,3 .10-5; Кг = 5,65 .10-11; рН = 8,03)
7. Определить концентрацию ионов водорода в 0,01 М растворе H2[SiF6].
(Ответ: С = 0,02 моль/л)
8. Закончить уравнения реакций. Для а) определить DG 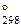 реакции:
реакции:
KMnO4 + K2PbO2 + KOH; б) HIO3 + H2O2.
(Ответ: DG 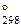 = –69,48 кДж)
= –69,48 кДж)
9. Составить схему и рассчитать ЭДС гальванического элемента, состоящего из стандартных водородного и цинкового электродов. Написать уравнения электродных процессов.
(Ответ: DЕ = 0,76 В)
10. Определить напряжение разложения 1н. раствора H2SO4 на электродах из гладкой платины (Т = 298 К).
(Ответ: Uразл. = 2,03 В)
Литература: 1, с. 299–309; 2, с. 452–457.
