Учебно-лабораторный практикум
ЛАБОРАТОРНЫЕ РАБОТЫ
ПО КУРСУ «ХИМИЯ»
Учебно-лабораторный практикум
Издание первое
Тверь 2009
УДК 546 (076.5)
ББК 24.1 я 7
Автономова Е.Н. Лабораторные работы по курсу «Химия»: Учебно-лабораторный практикум / Автономова Е.Н., Горцевич С.Л., Луцик В.И., Моргунова Е.В., Соболев А.Е., Чурсанов Ю.В.; 1-е изд. Тверь: ТГТУ, 2009. – 116 с.
Дано краткое изложение теоретических основ разделов и приведены описания лабораторных работ по курсу "Химия" для студентов инженерных направлений и специальностей технического университета.Рецензенты:
ISBN
© Тверской государственный
технический университет, 2009
ПРЕДИСЛОВИЕ
Настоящий практикум построен так, чтобы студент, используя только это издание, мог подготовиться к выполнению лабораторной работы, получить экспериментальные результаты, правильно их обработать и подготовиться к защите лабораторной работы. Он содержит краткое, но достаточно информативное теоретическое введение и обоснование лабораторной работы, подробное описание экспериментального исследования…..
1. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
Атомно-молекулярное учение имеет особое значение для развития химии. В его основе атомистика материалистов древней Греции (Левкипп 500 – 440 до н. э., Демокрит 460 – 370 до н. э., Эпикур 342 – 270 до н. э.), которые на основе логики и путем дискуссий разработали философское учение о дискретном строении материи. Угнетение науки со стороны религии привело к тому, что важнейшие фундаментальные идеи атомистики не получили развития до середины второго тысячелетия. Возрождение атомистики началось с трудов французского философа Пьера Гассенди (1592–1655 гг.), собравшего воедино забытые концепции древнегреческих философов, которые он подробно изложил в своих трудах “О жизни, нравах и учении Эпикура” и “Свод философии Эпикура”. В этот период Р. Бойлем (1627 – 1691 гг.) был установлен фундаментальный закон, описывающий зависимость объема газа от его давления. Объяснение этой зависимости могла дать только атомистика: если газ имеет дискретное строение, то легкость его сжатия обусловлена сближением атомов в результате уменьшения свободного пространства между ними (в то время молекулярное строение газов еще не было установлено). Первая попытка применения атомистики для количественной оценки наблюдаемых явлений природы привела к важным выводам: 1) превратившись из философской гипотезы в научную концепцию, атомистика становится мощным инструментом, позволяющим давать единственно правильную трактовку разнообразным явлениям природы; 2) для скорейшего превращения атомистики из философской гипотезы в научную концепцию доказательство существования атомов необходимо искать прежде всего при изучении газов. Однако пройдет еще около 100 лет, прежде чем химики займутся исследованием газов. Именно тогда последует серия открытий простых веществ: водород, кислород, азот, хлор. Несколько позже исследования поведения газов приведут к установлению законов, которые принято называть основными законами химии. Они и позволили сформулировать важнейшие положения атомно-молекулярного учения.Основные количественные законы
Ход работы
Собрать установку, схема которой приведена на рис. 1.1.
В кристаллизатор налить примерно ½ объема воды (используется в качестве гидрозатвора).
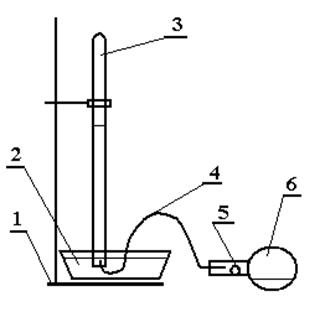
Рис. 1.1. Установка для измерения объема выделившегося водорода:
1 – штатив; 2 – кристаллизатор с водой; 3 – эвдиометр; 4 – газоотводная трубка; 5 – навеска металла; 6 – колба с раствором кислоты.
Набрать в стакан водопроводной воды и налить в эвдиометр. Закрыть его отверстие большим пальцем руки, опрокинуть и опустить открытый край эвдиометра в воду, налитую в кристаллизатор. Закрепить эвдиометр в штативе (фиксируйте, но не зажимайте сильно его лапку).
Подвести под эвдиометр газоотводную трубку. Если уровень мениска воды в эвдиометре находится выше шкалы, необходимо немного приподнять эвдиометр и пустить в него небольшой пузырь воздуха.
На технических весах определить массу выданного образца металла (от 100 до 200 мг). Полученное значение записать в лабораторный журнал.
Отмерить цилиндром и перелить в реакционную колбу 10-15 мл раствора хлороводородной кислоты HCl (1:2).
Взвешенный кусочек металла положить в горлышко колбы, повернутой горизонтально, чтобы растворение металла не началось до полной сборки системы.
Колбу закрыть пробкой с газоотводной трубкой, обеспечив герметичность системы улавливания газа.
Записать значение объема воды в эвдиометре до начала опыта.
Колбу поставить в вертикальное положение, чтобы металл упал в кислоту.
После завершения выделения водорода записать конечное значение объема.
Оформление лабораторного отчета и расчет результата
Зарисовать схему прибора.
Написать уравнение реакции между металлом (Al, Fe, Sn или Zn) и хлороводородной кислотой.
Записать экспериментальные данные по следующей форме:
m – масса металла, г;
V1 – объем газа в эвдиометре до растворения металла, дм3;
V2 – объем газа в эвдиометре после растворения металла, дм3;
Vоэ(Н2) = 11,2 дм3/моль – объем моля эквивалентов водорода (н.у.);
Mэ(Н) = 1 г/моль – молярная масса эквивалента водорода;
t – температура в лаборатории, оС ;
Т – температура в лаборатории, К;
То – стандартная температура 273 К;
Ратм – атмосферное давление по барометру, мм.рт.ст. (перевести в кПа);
Ро – стандартное давление (760 мм рт.ст. = 101,325 кПа)
h1 – давление насыщенного водяного пара, при температуре проведения опыта (взять из табл. 1.3, перевести в кПа);
h2 – давление столба воды в эвдиометре по окончании опыта.
Для выбора значения h1 использовать данные табл.3.
Величину h2 рассчитать по формуле:
h2 = ρ(H2O) ·g ·h(H2O),
где ρ(H2O) = 1000 кг/м3 – плотность воды;
g = 9,81 м/с2 – ускорение свободного падения;
h(H2O) – высота столба воды в эвдиометре, м.
Введение
Раствором называют гомогенную систему, состоящую из двух или более компонентов, состав которой может изменяться в определенных пределах. Растворы могут быть газообразными, жидкими и твердыми.
Для жидких растворов растворенными считают те компоненты, которые при обычных условиях находятся в агрегатном состоянии, отличном от раствора. Остальные компоненты представляют растворитель. Если жидких компонентов два или более, то растворителем считают вещество, присутствующее в смеси в большем количестве.
Концентрацию вещества в насыщенном растворе называют растворимостью. Часто растворимость выражают в граммах на 100 г растворителя.
Важной характеристикой раствора служит его количественный состав, определяемый концентрацией компонентов. Концентрация раствора это отношение числа частиц, либо количества вещества (моль), либо массы компонента к объему системы.
При расчетах приняты следующие обозначения:
m(A) – масса вещества A (г, кг).
m(р-р); m(р-ритель) – масса раствора или растворителя (г,кг).
M(A) – молярная масса вещества А, (г/моль).
fэкв(A) – фактор эквивалентности вещества А в реакции, которая должна быть обязательно указана. Например, для реакции
2NaOH + H2SO4 = Na2SO4 + 2Н2О
fэкв(NaOH) = 1/1; fэкв(H2SO4) = 1/2.
M[fэкв(А)] = M(A)×fэкв(А) – молярная масса эквивалента, г/моль;
n(A) – количество молей вещества;
n[fэкв(A)] – количество моль эквивалентов вещества А;
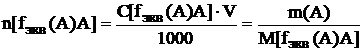
V – объем раствора (см3, дм3);
r - плотность раствора, г/см3.
Химические процессы протекают с изменением энергетического состояния веществ (сопровождаются выделением или поглощением теплоты) и упорядоченности их строения. Для анализа этого аспекта химического взаимодействия используют понятие «система». Системой называется совокупность тел, находящихся во взаимодействии и мысленно выделенных из окружающей среды. Термодинамика изучает свойства макроскопических систем на основе возможных превращений энергии без рассмотрения их микросостояний. Важнейшим результатом термодинамического исследования предполагаемых изменений в системе является вывод о возможности или невозможности самопроизвольного протекания процесса в выбранных условиях.
Если вопрос о возможности протекания реакции решен, возникает проблема оценки скорости реакции и возможности управления ею. Этот аспект химического взаимодействия изучает химическая кинетика – учение о скоростях и механизме реакций.
Ниже обсуждены важнейшие термодинамические и кинетические характеристики и закономерности протекания химических процессов и дано описание опытов, позволяющих исследовать их экспериментально.
Экспериментальная часть
Образование дисперсных систем и их свойства
Получают ДС двумя противоположными путями – диспергированием грубых частиц на более мелкие и агрегацией молекул или ионов в более крупные частицы. Диспергирование осуществляется при механическом измельчении, распылении или перехода во взвешенное состояние уже существующей, но осажденной дисперсной фазы (пептизация). Агрегация может быть осуществлена физическим методом (конденсация пара с образованием тумана) или – химическим (при протекании реакции осаждения, приводящей к образованию золя или геля).
4.2.1. Удельная поверхность дисперсных систем
Дисперсные системы обладают колоссальной удельной площадью поверхности раздела фаз. Это обусловлено увеличением площади удельной поверхности частиц при измельчении. Так, если частицу в 1 см3 раздробить до частиц с длиной ребра 10–7 м, то поверхность раздела фаз увеличится от 6 см2 до 600 м2. Известно, что 1 г активированного угля обладает суммарной поверхностью (внешней и внутренних пор) до 1000 м2.
На поверхности частицы дисперсной фазы и внутри нее молекулы неравноценны по запасу сил межмолекулярного взаимодействия. Молекулы внутри частицы испытывают взаимодействие соседних молекул по всем направлениям, для них силы межмолекулярного притяжения (Р) компенсированы и их сумма равна нулю (рис 1 а).
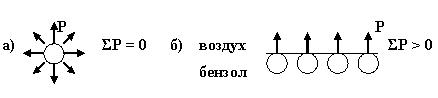
Рис. 4.1. Силы межмолекулярного взаимодействия молекулы внутри
дисперсной частицы (а) и на поверхности раздела фаз (б)
Молекулы на границе раздела фаз (например, масло-вода, вода-воздух, бензол-воздух) обладают некомпенсированными силами межмолекулярного взаимодействия, для них ΣР > 0. Эти силы в совокупности создают свободную поверхностную энергию (F), прямо пропорциональную удельной площади поверхности раздела фаз Sуд.
F = σ Sуд (4.1)
σ, Дж/м2, – удельная поверхностная энергия, называемая поверхностным натяжением. Величину σ можно интерпретировать как работу по созданию единицы площади поверхности раздела фаз.
Удельная площадь поверхности раздела фаз Sуд определяется отношением площади поверхности к объему частиц дисперсной фазы:
Sуд = S / V (4.2)
Согласно второму закону термодинамики, система самопроизвольно стремится перейти в состояние с меньшим запасом свободной поверхностной энергии (F → Fmin). Следовательно, ДС являются термодинамически неустойчивыми. Это проявляется в стремлении системы к снижению запаса поверхностной энергии F, котороеделает дисперсную систему агрегативно неустойчивой.
4.2.2. Факторы, влияющие на устойчивость дисперсных систем
Стремление F → Fmin может быть реализовано путем уменьшения площади удельной поверхности Sуд → Sуд min или путем снижения величины поверхностного натяжения σ.
Укрупнение – коагуляция частиц суспензии и коалесценция – слияние капель эмульсии приводят к уменьшению величины Sуд, а значит и F. Слипание частиц обусловлено силами межмолекулярного притяжения. Коагуляция и коалесценция могут завершаться разрушением дисперсной системы, когда под действием сил гравитации крупные тяжелые частицы самопроизвольно оседают на дно. Это явление называется седиментацией. Укрупненные капли легкой фазы в эмульсиях всплывают на поверхность, образуя два слоя с четкой или размытой поверхностью раздела фаз. Система из микрогетерогенной превращается в гетерогенную. Таким образом, ДС являются агрегативно неустойчивыми системами.
Удельная площадь поверхности дисперсной фазы Sуд может не уменьшаться, если будут компенсированы силы свободной поверхностной энергии. Это явление имеет место тогда, когда на поверхности частиц дисперсной фазы адсорбируются молекулы другого вещества (адсорбтива), имеющего физико-химическое сродство к веществу дисперсной фазы.
Адсорбцией называют самопроизвольное концентрирование вещества на границе раздела фаз. Она происходит на любых межфазных поверхностях, и адсорбироваться могут любые вещества. Часто взаимодействие, приводящее к адсорбции, имеет физическую природу. Возможно также образование химических связей между молекулами адсорбированного соединения и вещества на границе раздела фаз. Этот вариант адсорбции называется хемосорбцией. В ряде случаев поглощение одного вещества другим не ограничивается поверхностным слоем, а происходит во всем объеме сорбента. Такое поглощение называют абсорбцией.
Адсорбция газов и паров на поверхности твердых тел сопровождается уменьшением свободной поверхностной энергии системы F, что приводит к ее стабилизации. В результате адсорбции происходит перераспределение компонентов между объемными фазами и поверхностными слоями.
Важнейшей адсорбционной характеристикой вещества является поверхностная активность, выражаемая в Дж∙м2/моль или Н∙м/моль. Если с увеличением концентрации некоторого вещества на границе раздела фаз величина σ понижается, то его называют поверхностно-активным веществом(ПАВ). Например, для масляной кислоты σ = 26,5∙10–3 Дж/м2, следовательно это ПАВ.
Большинство органических веществ имеют значение σ меньшее, чем вода (для воды σ = 72∙10–3 Дж/м2), поэтому по отношению к воде они поверхностно активны.
Молекулы ПАВ имеют особое строение: неполярную углеводородную цепь и полярную часть, представленную функциональными группами –COOH, –NH2, –OH, –O–, –SO2OH и др. Углеводородные неполярные части молекул ПАВ выталкиваются из воды и концентрируются на поверхности раздела фаз – адсорбируются. ПАВ типа обычного мыла (олеат натрия) при концентрации 10–6 моль/см3 снижают σ воды при 298 К с 72∙10–3 до 32∙10–3 Дж/м2. В результате вода с добавкой ПАВ стекает, не оставляя “жирных” капель, бензин смывается с рук.
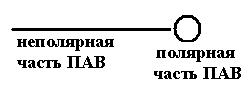
Рис. 4.2. Схематическое строение молекулы ПАВ
Молекулы ПАВ неполярной частью обращаются к неполярному веществу дисперсных частиц (бензол, частицы загрязняющих веществ), а полярной группой связываются с полярными молекулами вещества дисперсионной среды (например, воды). Так, на частичке загрязняющего вещества молекулы ПАВ ориентируются как частокол, образуя моно- или полимолекулярные слои. Схема распределения молекул ПАВ на границе раздела фаз изображена на рис. 4.3.
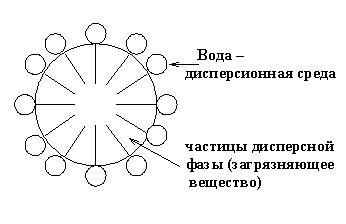
Рис. 4.3. Схема распределения молекул ПАВ на границе раздела фаз
Частицы дисперсной фазы, окруженные ПАВ, увлекаются в объем дисперсионной среды (моющего раствора), отрываясь от загрязненной поверхности.
4.3. Высокодисперсные системы – золи (коллоидные растворы)
Золи обладают повышенной агрегативной устойчивостью и могут существовать долгое время без изменения степени дисперсности. Это объясняется особым строением коллоидных частиц. В качестве примера рассмотрим строение золя иодида серебра, образующегося в результате реакции ионного обмена нитрата серебра с иодидом калия при избытке последнего:
AgNO3 + KI = AgI↓ + KNO3.
В начале осаждения образуются мельчайшие кристаллы AgI – зародыши микрокристаллического ядра, на поверхности которых адсорбируются ионы Ag+ , входящие в состав кристаллов и в избытке присутствующие в растворе. Эти ионы (Ag+) называют потенциалопределяющими. Они притягивают к себе ионы противоположного знака (NO3–). Так, на поверхности ядра AgI формируется двойной электрический слой из адсорбированных потенциалопределяющих ионов (Ag+) и противоионов (NO3–). Адсорбированные ионы достаточно прочно связаны с ядром силами межмолекулярного притяжения. Ядро с адсорбционным слоем образует гранулу. Каждая гранула несет заряд. В рассматриваемом примере – положительный. Одноименно заряженные гранулы взаимно отталкиваются. Это препятствует коагуляции ДС и обеспечивает кинетическую устойчивость коллоидных растворов. Часть ионов NO3–, компенсирующих заряд гранулы, не адсорбированы, а удалены от ядра и образуют диффузионный слой коллоидной частицы, которая в целом называется мицеллой. Таким образом, мицеллы нейтральны.
Образование золя иодида серебра при избытке нитрата серебра приводит к такому строению коллоидных мицелл, при котором гранулы имеют положительный заряд (рис. 4.4):
{[AgI]m · nAg+ · (n-x)NO3–}x+ · x NO3–. (4.3)
Строение мицеллы золя иодида серебра, образовавшегося при избытеа иодида калия может быть выражено формулой:
{[AgI]m · nI– · (n-x)K+}x– · x K+. (4.3)
Наличие заряженных гранул в составе коллоидных мицелл подтверждает явление электрофореза, заключающееся в том, что при пропускании постоянного электрического тока происходит перемещение гранул к электроду противоположного знака и перемещение противоионов диффузионного слоя, соответственно, к противоположному электроду.
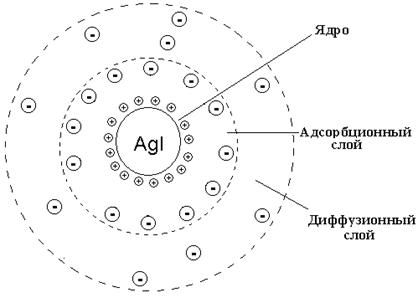
Рис. 4.4. Строение коллоидной мицеллы золя иодида серебра
при избытке азотнокислого серебра
4.4. Связнодисперсные системы – гели
Дисперсные системы с жидкой или газообразной дисперсионной средой, обладающие некоторыми свойствами твёрдых тел: способностью сохранять форму, прочностью, упругостью, пластичностью. Эти свойства гелей обусловлены существованием у них структурной сетки (каркаса), образованной частицами дисперсной фазы, которые связаны между собой силами межмолекулярного взаимодействия различной природы.
Гели в виде студенистых осадков (коагелей) образуются из золей при их коагуляции или в процессах выделения новой фазы из пересыщенных растворов как низко-, так и высокомолекулярных веществ. Гели с водной дисперсионной средой называют гидрогелями, с жидкой углеводородной средой – органогелями. Отверждение золей во всём объёме без выделения осадка и нарушения их однородности даёт т. н. лиогели. Вся дисперсионная среда в таких гелях лишена подвижности (иммобилизована) вследствие изолирования в ячейках структурной сетки. Чем больше асимметрия частиц, тем при более низком содержании дисперсной фазы образуется гель. Например, при образовании гидрогеля из гидрозоля пентоксида ванадия для отверждения системы достаточно 0,05%, в других случаях – нескольких объёмных процентов дисперсной фазы. Лиогели обладают малой прочностью, пластичностью, некоторой эластичностью и тиксотропией, т. е. способностью обратимо восстанавливать структуру, разрушенную механическим воздействием. Таковы, например, гели мыл и мылоподобных поверхностно-активных веществ, гели гидроксидов многих поливалентных металлов. Высушиванием лиогелей можно получить аэрогели, или ксерогели, – микропористые системы, лишённые пластичности, имеющие хрупкую, необратимо разрушаемую структуру. Так получают распространённые сорбенты: алюмогель из геля гидроксида алюминия и силикагель из студней кремнёвой кислоты.
Экспериментальная часть
4.5.1. Получение суспензии мыла в воде
и исследование ее свойств(опыт 4.5.1)
Налейте в две цилиндрические пробирки до ½ объема каждой дистиллированной воды и внесите по 1 микрошпателю порошка мела. В одну из пробирок добавьте 1 мл 1%-ного раствора мыла. Пробирки закройте пробками и сильно встряхните.
Включив секундомер, наблюдайте расслоение полученной суспензии. Отметьте время до осветления верхней водной фазы в каждой из пробирок. Наблюдайте седиментацию крупных тяжелых частиц.
Как влияет добавка мыла на скорость разрушения суспензии?
Перенесите стеклянной палочкой 2 – 3 капли мутной жидкости (без мыла) на зеркало и рассмотрите суспензию через лупу. Охарактеризуйте полученную суспензию. Ответьте на вопросы:
Что является дисперсионной средой?
Каков химический состав дисперсной фазы?
Сравните размеры частиц дисперсной фазы в полученной суспензии.
Моно- или полидисперсной системой является данная суспензия?
Повышает ли агрегативную устойчивость добавка мыла?
Обсудите роль молекул мыла С17Н35СООNa?
4.5.2. Получение эмульсии бензола в воде(опыт 4.5.2)
В две пробирки налить до ½ дистиллированной воды и в каждую добавить 8 – 10 капель бензола. В одну из пробирок добавить 10 капель 1%-ного раствора мыла. Обе пробирки плотно закрыть резиновыми пробками и сильно встряхнуть. По секундомеру наблюдать от момента встряхивание расслоение эмульсии. Убедитесь в том, что в присутствии мыла эмульсия более стабильна во времени. Наблюдайте быстрое расслоение эмульсии в пробирке без добавок мыла.
Как объяснить повышение агрегативной устойчивости эмульсии добавками мыла?
Изобразите схематически адсорбцию молекул мыла на поверхности капель бензола.
Объясните причину адсорбции ПАВ на поверхности капелек бензола.
4.5.3. Испытание действия моющего средства(опыт 4.5.3)
Каплю растительного масла нанесите на ладонь и попытайтесь смыть водой. В случае неудачи, смойте каплю при помощи мыла. Вместо мыла в качестве ПАВ можно использовать другое вещество, например, стиральный порошок.
Какова роль мыла в процессе смывания растительного масла с кожи рук?
Как ориентированы ионы стеариновой кислоты (С17Н35СОО–) в этой системе?
4.5.4. Образование геля кремниевой кислоты(опыт 4.5.4).
В пробирку внести 6 капель 2 М раствора хлороводородной кислоты и добавить, встряхивая пробирку, 15 капель 10%-ного раствора силиката натрия. Отметить образование золя кремниевой кислоты и наблюдать превращение в гель.
Чем объясняется образование гелей? Почему гели теряют текучесть?
В каких случаях возможно превращение золя в гель?
4.5.5. Получение геля кремниевой кислоты из золя(опыт 4.5.5)
В цилиндрическую пробирку налить 3 – 5 капель концентрированной хлороводородной кислоты (ρ = 1,19 г/см3), внести 1 – 2 капли насыщенного раствора силиката натрия (силикатный клей) и смесь встряхнуть. Полученный золь кремниевой кислоты нагреть на водяной бане до перехода золя в гель.
Объясните роль нагревания. Чем отличается золь от геля?
Какие золи можно превратить в гель и наоборот?
4.5.6. Получение коллоидного раствора гидроксида железа при гидролизе соли железа(опыт 4.5.6)
В стакан емкостью 50 мл налить 20 мл дистиллированной воды и нагреть на плитке до кипения. Снять стакан с плитки, и в горячую воду при помешивании стеклянной палочкой внести 30 капель раствора хлорида железа (III). Полученный раствор снова нагреть и кипятить в течение 1 – 2 минут. Отметить красный цвет золя гидроксида железа. Оставить стаканчик с полученным золем до следующего опыта.
Составьте ионное и молекулярное уравнение гидролиза хлорида железа (III), который при нагревании и высокой степени разбавления протекает до конца, т.е. до образования гидроксида железа (III). Изобразите графически строение коллоидной мицеллы. В центре находится ядро из молекул гидроксида железа (III), на его поверхности адсорбируются ионы FeО+ и противоионы. Укажите знак заряда коллоидной гранулы.
Добавкой каких ионов можно нейтрализовать заряд гранул и вызвать их коагуляцию?
4.5.7. Коагуляция золя гидроксида железа (III) электролитами(опыт 4.5.7)
Раствор, приготовленный в опыте 6, налейте в 4 пробирки до ½ их объема. В одну пробирку добавьте 1 – 2 капли 0,5 M раствора хлорида натрия; во вторую – столько же 0,5 М раствора сульфата натрия.
В какой пробирке наблюдается помутнение, т.е. коагуляция коллоидных частиц и образование суспензии?
В третью пробирку добавьте насыщенный раствор хлорида натрия до появления мути.
Обсудите явление устойчивости коллоидных растворов и их коагуляцию под действием электролитов.
4.5.8. Адсорбция активированным углем красителя из растворов(опыт 4.5.8)
В стеклянную воронку вложить бумажный фильтр, плотно пригнать его к стенкам воронки, слегка смочить водой. Закрепить воронку в штативе; внести на фильтр 5 – 6 микрошпателей активированного угля (можно использовать толченый древесный уголь). Взять ½ пробирки интенсивно окрашенного раствора лакмуса, фуксина или другого раствора и профильтровать его через слой угля.
Сравните окраску раствора до и после фильтрации.
Чем объясняются адсорбционные свойства угля?
4.5.9. Адсорбция активированным углем ионов тяжелых металлов(опыт 4.5.9)
В одну пробирку внести 3 – 4 капли 0,01 н раствора соли свинца и добавить 1 каплю 0,01 н раствора иодида калия. Отметить выпадение обильного желтого осадка иодида свинца. Составить уравнение протекающей реакции ионного обмена.
В другую пробирку внести 10 – 15 капель 0,01 н раствора нитрата свинца и добавить 2 микрошпателя активированного угля, закрыть пробкой пробирку, встряхивать в течение 2-3-х минут. Затем капельной пипеткой, обернутой ватой, отобрать 3 – 4 капли прозрачного раствора соли свинца и перенести в другую чистую пробирку. Внести в нее 1 каплю 0,01н раствора иодида калия и наблюдать результат.
Какое явление называют адсорбцией?
Обсудите адсорбционные свойства активированного угля.
При каких условиях выпадает осадок (обсудите, привлекая понятие произведения растворимости ПР)?
Экспериментальная часть
Реактивы:
водный раствор неизвестного неэлектролита А с массовой долей растворенного вещества 30% (плотность раствора – 1,08 г/см3), дистиллированная вода, лед, поваренная соль.
Оборудование:
прибор для криоскопических исследований (криостат) (рис. 5.4); химический стакан для приготовления исследуемого раствора; кристаллизатор для приготовления охлаждающей смеси; две бюретки (с 30%-ным раствором вещества А и дистиллированной водой); шпатель; секундомер.
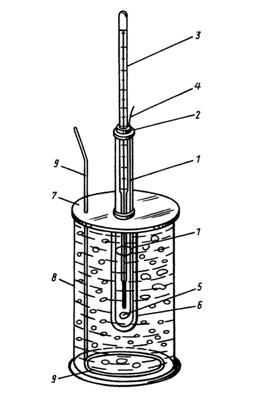
Рис. 5.4. Прибор для криоскопических исследований (криостат):
1– внутренняя пробирка; 2 – пробка внутренней пробирки; 3 – термометр с ценой деления 0,1 оС; 4 – мешалка для перемешивания раствора; 5 – кольцо мешалки; 6 – наружняя пробирка; 7 – крышка; 8 – стеклянный сосуд с охлаждающей смесью; 9 – мешалка для охлаждающей смеси.
(В некоторых криостатах позиции 4, 5 и 9 могут отсутствовать.)
Ход работы:
1. Приготовьте раствор для исследования. Для этого в химический стакан с помощью бюретки сначала налейте a мл 30%-ного раствора вещества А. Затем с помощью другой бюретки внесите в этот же стакан b мл дистиллированной воды. (Значения объемов a и b указывает преподаватель.) Полученный раствор тщательно перемешайте.
2. В кристаллизаторе приготовьте охлаждающую смесь из льда и соли. Заполните ею стеклянный сосуд криостата.
3. Внутреннюю пробирку криостата до ~ ½ ее объема заполните приготовленным раствором вещества А. Не пытайтесь залить в пробирку весь приготовленный раствор! Убедитесь, что при погружении пробирки в криостат раствор в ней будет полностью окружен охлаждающей смесью.
4. Поместите пробирку с раствором в охлаждающую смесь и фиксируйте изменение температуры в пробирке через каждые 15 секунд. Осторожно перемешивайте раствор в пробирке мешалкой или (если ее нет) термометром. Старайтесь не повредить термометр!
5. Полученные экспериментальные данные занесите в таблицу (табл. 5.2).
Таблица 5.2
Зависимость температуры раствора от продолжительности охлаждения
| τ, с | … | ||||||||
| t, oС |
5. Продолжайте измерение температуры до тех пор, пока она не достигнет значения –10 оС. По окончании опыта выньте внутреннюю пробирку из криостата, поместите ее под струю теплой водопроводной воды и дождитесь, пока кристаллы расплавятся. Затем раствор из пробирки можно вылить.
6. По данным таблицы постройте график зависимости температуры раствора от времени его охлаждения t = f(τ) в пределах изменения температур от +5 до –10 оС (точки, выходящие за эти границы, на график не наносите). Вид полученного графика должен соответствовать рис. 5.3.
7. По графику определите температуру кристаллизации раствора tкр(р-ра). Вычислите понижение температуры кристаллизации раствора в сравнении с чистым растворителем ∆Ткр.
8. Вычислите массу растворенного вещества и массу растворителя в приготовленном растворе:
mв-ва = Vр-ра А · ρр-ра · ω(А);
mв-ва = a · 1,08 · 0,3 = … г;
mводы = Vр-ра А · ρр-ра · (1 – ω(А)) + Vводы · ρводы;
mводы = а · 1,08 · (1 – 0,3) + b · 1 = … г.
9. По формуле (6) рассчитайте молярную массу неизвестного неэлектролита А.
10. Узнайте у преподавателя справочное значение М(А) и вычислите относительную ошибку эксперимента:
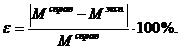 (5.7)
(5.7)
5.3. Контрольные вопросы для защиты работы
1. От чего зависят температуры кипения и кристаллизации раствора?
2. Каков физический смысл криоскопической и эбуллиоскопической постоянных?
3. Как можно использовать данные по определению температуры кристаллизации раствора для определения молярной массы растворенного вещества?
4. Каким образом можно использовать данные по определению температуры кристаллизации раствора для обнаружения диссоциации электролитов в водных растворах?
5. В каком из следующих 0,1-моляльных растворов: а) HNO3; б) NaCl; в) C6H12O6; г) CuSO4; д) BaCl2 – изменение температуры кристаллизации будет наибольшим?
Примеры контрольных задач по теме лабораторной работы
1. Раствор, содержащий 2,5 г C6H5OH в 91 г бензола, начинает кристаллизоваться при 3,8 оС. Вычислите криоскопическую постоянную бензола, зная, что чистый бензол кристаллизуется при 5,5 оС.
2. Определите молярную массу спирта, если известно, что раствор, содержащий 0,874 г спирта в 100 г воды, начинает кристаллизоваться при температуре –0,354 оС.
3. При какой температуре замерзает антифриз, состоящий из 9 л воды и 2 л метилового спирта СН3ОН (плотность 0,8 г/см3)?
6. ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТОВ
6.1. Основные понятия и закономерности
Соединения, растворы и расплавы которых проводят электрический ток, называют электролитами.
Согласно теории электролитической диссоциации С.Аррениуса (1887):
– при растворении кислоты, основания и соли диссоциируют на ионы;
– диссоциация протекает лишь частично; доля продиссоциировавших молекул называется степенью диссоциации (0 <α< 1); разбавление и рост Т приводит к увеличениюα;
– к равновесию диссоциации применим закон действующих масс.
Для равновесия НСN ↔ H+ + CN- ,
Kд = [H+].[CN-] / [HCN]. (6.1)
Диссоциируют ионные и полярные ковалентные соединения. Чем выше диэлектрическая постоянная растворителя (ε0), тем сильнее его ионизирующее действие [α = f(ε0) ]. Ассоциации ионов препятствует их сольватная (гидратная) оболочка.
Изотонический коэффициентВант-Гоффа (i) показывает, во сколько раз число частиц в растворе превышает число растворенных молекул. Коэффициент i можно рассчитатьпо величине α, которая, в свою очередь, может быть найдена из значения константы диссоциации электролита КД:
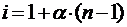 ,(6.2)
,(6.2)
где n – количество ионов, на которые распадается молекула при диссоциации.
Законы Рауля и Вант-Гоффа для разбавленных растворов электролитов имеют вид:
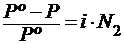 ; (6.3)
; (6.3)
ΔТкр = i · Ккр· Сm ;(6.4)
ΔТкип = i · Е· Сm ;(6.5)
Росм = i ·СM· R·T.(6.6)
Электролиты называютсильными, если при Сн = 1 моль/дм3 α> 0,5 (к ним относятвсе соли, HCl,H2SO4,HNO3,NaOH,Ba(OH)2 и др.), и слабыми, если при Сн = 1 моль/дм3 α < 0,5 (CH3COOH,HCN,H2S,HNO2,H2CO3,H2SO3, Сu(OH)2,Zn(OH)2,Fe(OH)2,Fe(OH)3и др.).
Закон разбавления Оствальда связывает константу равновесия диссоциации слабого электролита Кд с величиной степени диссоциации α при данной молярной концентрации С
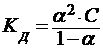 , а при α << 1:
, а при α << 1: 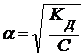 . (6.7)
. (6.7)
Электролиты, проявляющие свойства и кислот, и оснований, называют амфотерными. Пример амфотерного соединения – гидроксид цинка Zn(OH)2:
Zn(OH)2 + 2 H+ = Zn2+ + 2 H2O;
Zn(OH)2 + 2 ОH– = ZnО22– + 2 H2O(при сплавлении);
Zn(OH)2 + 2 OH– = [Zn(OH)4]2–(в растворе).
Ионные равновесия и реакции. Реакции ионного обмена протекают в том случае, когда возможно образование менее диссоциированных продуктов, чем исходные вещества. При составлении ионных уравнений принято сильные электролиты записывать в ионной форме, а слабые – в молекулярной. Например, для реакции нейтрализации сильной кислоты сильным основанием ионное уравнение имеет вид:
Н+ + ОН– = H2O.
Равновесие диссоциации воды. Для водных растворов ионное произведение Кw– величина постоянная при данной температуре:
Кw = [H+]·[OH–] = 1 ·10–14(при t = 25 oC). (6.8)
Водородный показатель – логарифмическая форма выражения молярной концентрации свободных ионов Н+:
рН = –lg[H+].(6.9)
