Галогенпроизводные углеводородов
Органическая химия это химия углеводородов и их производных.
Галогенпроизводные углеводородов можно рассматривать как продукты замещения в углеводородах одного или нескольких атомов водорода атомами галогенов (F, Cl, Br, I). Изомерия их обусловлена изомерией углеродного скелета и положением атома галогена. Поляризация связи в алкилгалогенидах способствует замещению атома галогена на другие атомы или частицы, обладающие нуклеофильным характером.
В зависимости от структуры алкилгалогенида, силы нуклеофильного агента, условий процесса и природы растворителя реакции нуклеофильного замещения могут быть реализованы по механизмам бимолекулярного нуклеофильного замещения (SN2) или мономолекулярного нуклеофильного замещения (SNI).
Часто реакции, протекающие по механизму SNI, сопровождаются побочными реакциями мономолекулярного нуклеофильного отщепления Е (3). Скорость-определяющей стадией реакции, протекающей по механизму SNI, является диссоциация алкилгалогенида на ионы:
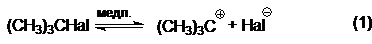
Завершающей стадией является быстрое взаимодействие образующегося карбкатиона с нуклеофилом:
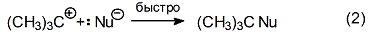
В то же время, при достаточно сильных оснόвных свойствах нуклеофила, последний может выполнять отщепляющую функцию по отношению к карбкатиону:
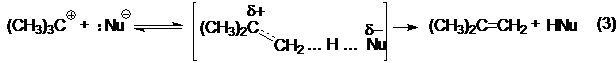
Таким образом, соотношение продуктов замещения-отщепления определяется конкуренцией реакций (2) и (3). Ключевой стадией для обеих реакций (SN1 и Е1) является реакция (1). Скорость процесса в целом определяется скоростью этой стадии, а, следовательно, ее энергетическим барьером. Образование более стабильного карбкатиона в реакции (1) обсуловливает понижение ее барьера и, следовательно, более высокую скорость процесса в целом. Это, в конечном счете, определяет ряд реакционной способности алкилгалогенидов в реакциях SN1:
(R)3CHaI > ( R )2CHHaI > RCH2HaI и предпочтительное протекание по этому механизму реакций третичных алкилгалогенидов.
С другой стороны реакционная способность алкилгалогенида зависит от галогена в субстрате и возрастает в соответствии с уменьшением энергии диссоциации связей С-НаI в алкилгалогениде:
Энергия диссоциации связи С-НаI: C-F > C-Cl > C-Br > C-I
Скорость реакции SNI (E1): R-F < R-Cl < R-Br < R-I
Поскольку в скорость-определяющей стадии нуклеофил :Nuq не участвует, природа и концентрация последнего не оказывают влияния на скорость процесса.
В бимолекулярном нуклеофильном замещении SN2 происходит синхронный разрыв связи С-Наl и образование связи С-Nu:
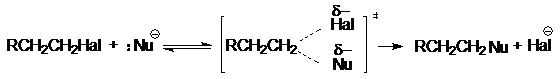
Как правило, эта реакция сопровождается конкурентной реакцией нуклеофильного отщепления Е2:
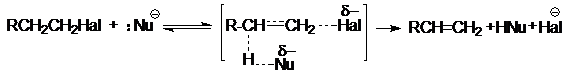
И в SNI-, и в SN2-реакциях соотношение продуктов замещения и отщепления определяется соотношением поляризуемости и основности в нуклеофиле. Как правило, если атакующим агентом при реализации SN2-механизма является нуклеофил-анион, то электроноакцепторные заместители при атакуемом атоме углерода ускоряют процесс, а электронодонорные − наоборот.
Реакционная способность различных галогенидов в бимолекулярном нуклеофильном замещении увеличивается в соответствии с уменьшением энергии диссоциации связей С-НаI, как и в случае SNI, поскольку в обоих случаях разрыв связей С-НаI влияет на скорость-определяющей стадии.
Реакция SN2 протекает в одну стадию с участием нуклеофила, поэтому его сила и концентрация оказывает ускоряющее действие на процесс.
Реакция замещения позволяют перейти от алкилгалогенидов ко многим классам органических соединений:

Важнейшими реакциями нуклеофильного отщепления (Е) является дегидратация спиртов, дегидрогалогенирование с образованием алкенов, алкинов и др.
Ароматические галогенопроизводные подразделяются по строению, свойствам и методам получения на две группы:
1) соединения, содержащие атом галогена в ядре;
2) соединения, содержащие атом галогена в боковой цепи.
Для получения соединений с атомом галогена в ароматическом кольце используют реакции замещения, протекающие по SЕ-механизму в присутствии катализаторов: AlCl3, FeCl3, BF3. Для получения соединений с галогеном в боковой цепи используют реакции замещения по SR-механизму.
Химические свойства соединений, имеющих галоген в ядре, определяются ограниченной подвижностью атома галогена вследствие частичной двоесвязанности его с ядром за счет мезомерного эффекта:
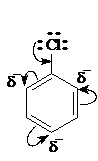
Трудность нуклеофильного замещения, атома галогена связанного с ядром, требует жестких условий для его реализации: сильного основания в качестве нуклеофила, высокой температуры и давления, а также катализаторов типа солей меди и серебра. Последние координируются с уходящей группой галогена, делая процесс энергетически более выгодным. Реакция протекает через образование неустойчивого продукта, дигидробензола. Например, при гидролизе хлорбензола, требуется температура 300 оС, давление 10 МПа, едкая щелочь в качестве нуклеофила и хлорид меди в качестве катализатора:
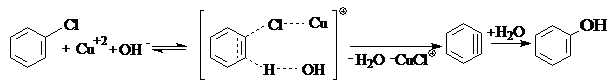
Являясь заместителем I-го рода, атом галогена направляет электрофильное замещение в о- и п-положения бензольного кольца, но скорости таких реакций ниже, чем у бензола.
Галогенопроизводные углеводородов находят применение в препаративной органической химии и в промышленном органическом синтезе (ядохимикаты, растворители и др.).
