Работа 2. Осмотическое давление растворов
4 часа.
Цель работы: наблюдать явление осмоса. Изучить действие полупроницаемых мембран осадочного типа.
План занятия
1. Сдача теоретического минимума (допуска) к работе.
2. Экспериментальное измерение осмотического давления растворов различной концентрации.
3. Изучение явления осмоса в различных процессах.
4. Составление отчета о работе.
Рекомендуемая литература.
1. Болдырев А. И. Физическая и коллоидная химия, - М.: Высшая школа, 1983.
2. Физическая химия. К. С. Краснов, М. К. Воробьёв, И. Н. Годлеев и др.; Под ред. К. С. Краснова. – М.: Высшая школа, 1995.
3. Чанг Р. Физическая химия с приложениями к биологическим системам. – М.: Мир, 1990.
Основная литература
1. Зимон А.Д. Физическая химия. Изд. 3-е. М.: Агар, 2006. – с. 52-76.
2. Зимон А.Д. Коллоидная химия. Изд. 5-е. М.: Агар, 2007. – с. 94-101.
Дополнительная литература
1. Болдырев А.И. Физическая и коллоидная химия, - М.: Высшая
школа, 2003.
2. Физическая химия. / К.С. Краснов, Н.К. Воробьев, И.Н. Годнев и др.; Под ред. К.С. Краснова. – М.: Высшая школа, 1995.
3. Чанг Р. Физическая химия с приложениями к биологическим системам. – М.: Мир, 1990.
Вопросы для самоподготовки
1. Что такое осмос? Осмотическое давление? Как они обнаруживаются?
2. Какие мембраны называются полупроницаемыми? Примеры. Каков механизм действия различных полупроницаемых мембран?
3. Как можно измерить осмотическое давление? Как рассчитать его по формулам?
4. Как ведёт себя вещество в растворённом состоянии? В чём его свойства аналогичны свойствам газов?
5. Каким законам подчиняется осмотическое давление? Приведите формулировки и математическое выражение этих законов.
6. Перечислите методы определения молекулярной массы растворённых веществ. В каких случаях могут быть использованы методы? Какие формулы для этого используются?
7. Какие свойства растворов зависят от природы компонентов, и какие не зависят от природы растворённого вещества, а определяются лишь его концентрацией?
8. Что такое обратный осмос? Где он находит практическое применение?
Краткие методические рекомендации
Приступая к выполнению опытов необходимо иметь чёткое теоретическое представление об осмосе и механизме его возникновения, а также об осмотическом давлении как результате осмоса. Знать свойства полупроницаемых мембран. Необходимо уметь объяснять наблюдаемые в опытах явления с точки зрения законов осмоса. Ответить на вопросы: "Можно ли использовать часть проведённых вами опытов на внеклассных занятиях на химии в школе? При изучении какой темы следует провести внеклассное занятие по выращиванию "Сад химика"?
Принадлежности для работы. Простейший осмометр, 5% раствор медного купороса, 0,2%, 0,9%? 4% растворы NaCl; C2H5OH-96%; игла медицинская для прокалывания кожи; кристаллические соли: K4[Fe(CN)6]; Ca(NO3)2; Mg(NO3)2; Cu(NO3)2; Ba(NO3)2; 10% раствор Na2SiO3, 10% раствор сахарозы, микроскоп с предметными стёклами и покровными стёклами.
Ход работы
Опыт 1. Измерение осмотического давления 10% раствора сахарозы. Для измерения осмотического давления раствора необходим осмометр (готовится лаборантом), который представляет собой сосуд, одна из стенок которого (дно) обладает свойствами полупроницаемой мембраны. Чтобы измерить осмотическое давление какого-либо раствора, поступают так: исследуемым раствором, подкрашенным эозином, заполняют осмометр почти до верхнего края. Затем осмометр плотно закрывают резиновой пробкой с тонкой стеклянной трубкой, следя за тем, чтобы под пробкой не остался пузырёк воздуха. (Смотреть табл. " схема осмометра").
Подготовленный т.о. осмометр погружают в сосуд с дистиллированной водой и наблюдают за подъёмом жидкости в стеклянной трубке. После прекращения подъёма жидкости измеряют высоту столба жидкости в трубке с помощью миллиметровой линейки, и рассчитываю приближённое значение осмотического давления по формуле:
Pосм= ρsh,
где Pосм – осмотическое давление в мм. рт. столба
ρ – плотность исследуемого раствора
s – площадь поперечного сечения стеклянной трубки осмометра
h – высота подъёма жидкости в трубке в мм.
Для перевода осмотического давления из мм. рт. столба в Паскали, необходимо помнить, что 1 мм. рт. столба равен 133,3 Па.
Точное значение осмотического давления (теоретическое) вычисляют по формуле: Pосм=CRT. Сравнить теоретическое значение (вычисляемое0 с осмотическим давлением, найденным в опытах и объяснить несовпадение результатов.
Опыт 2. Рост искусственной "клетки Траубе". Пробирку на 1/2 заполняют 5% раствором CuSO4 и опускают в неё кристаллик жёлтой кровяной соли. Наблюдают рост "клетки Траубе". Через 20-30 минут зарисовывают получившееся образование. Чтобы "клетка Траубе" получалась красивой, необходимо выбрать наиболее крупные кристаллы жёлтой кровяной соли. Записать уравнение реакции между раствором CuSO4 и жёлтой кровяной солью. Объяснить наблюдаемое явление.
Опыт 3. "Химические водоросли". (Сад химика). 5-6 пробирок на 1/3 заполняют 10% раствором Na2SiO3. Этот раствор легко готовится путём разбавления "жидкого стекла" в 2-3 раза. "Жидкое стекло" имеется в продаже в магазинах канцелярских товаров под названием "силикатный клей".
в каждую из пробирок опускают по1-2 кристалла имеющихся азотистых солей. Через час зарисовывают "химические водоросли", получившиеся в пробирках. Записывают все возможные уравнения реакций, протекающие в растворах в молекулярном и ионном виде. "Химические водоросли" часто называют "Садом химика", т.к. многие соли имеют характерную окраску (какие?), поэтому полученные "водоросли" могут быть разного цвета.
Однако работать с силикатом натрия неудобно, т.к. его растворы разрушают стекло, делая его мутным, и посуда становится непригодной для использования. Растворы силиката натрия трудно фильтруются, а в мутном растворе химические водоросли выглядят не так эффектно, как в прозрачном.
Кроме силиката натрия, в качестве среды для химических водорослей, можно использовать и другие растворы. Ниже приводится таблица 2, в которой указаны растворы, их концентрация и формулы кристаллических солей, необходимые для приготовления "сада химика".
В отличие от "клетки Траубе", "химические водоросли" могут сохраняться по нескольку дней, что даёт возможность использовать их для организации внекалссных занятий по химии в школе. Для демонстрации "сада химика" можно использовать вместо пробирок другие ёмкости, например, химические стаканчики на 50-1000мл.
Сад химика
Таблица 2
| Раствор | Конц. (в %) | Кристаллы |
| K4[Fe(CN)6] | 3-5 | CdCl2, ZnCl2, MnCl2, FeCl2 CoCl2, NiCl2,FeCl3 |
| K3[Fe(CN)6] | 3-5 | ZnCl2, FeCl2 |
| CdCl2, CuSO4 | 3-5 | K3[Fe(CN)6] |
| CuSO4 | 10-15 | K3[Fe(CN)6] |
| Pb(No3)2, NiCl2 | 3-5 | K4[Fe(CN)6] |
| K2CrO4 | 3-5 | BaCl2 |
| Na2B4O7 | 3-5 | AlCl3, Pb(No3)2 |
| Na2CO3 | 3-5 | BaCl2, CaCl2 |
| Na2CO3 | 5-20 | Sr(NO3), Ba(NO3) |
| Na2CO3 | 10-20 | MnCl2 |
| Pb(No3)2 | 10-20 | KI, BaI2, CdI2 |
| Pb(CH3COO)2 | KI, CdI2 | |
| CdI2 | Насыщ. | Pb(No3)2 |
| NaI | 3-5 | Pb(CH3COO)2 |
| NaI | Pb(No3)2 | |
| Na3PO4 | 2-4 | MgCl2 |
| Na3PO4 | 7-15 | CoCl2, ZnCl2, Sr(NO3), Ba(NO3) |
| Pb(No3)2 | 5-20 | Na3PO4 |
| Pb(No3)2 | (NH4)2Cr2O7 | |
| Na2ClO4 | 5-20 | Pb(CH3COO)2 |
| Pb(CH3COO)2 | 10-20 | K2CrO4, K2Cr2O7 |
| K2Cr2O7 | 3-20 | Pb(CH3COO)2, Pb(No3)2 |
| K2HPO4 | 3-4 | CdCl2, BaCl2, ZnCl2, FeCl2, MnCl2, CaCl2 |
| NaOH | CoCl2 | |
| Na2CrO4, | MnCl2, Cd(NO3)2, Sr(NO3), BaCl2, | |
| Na2SiO3 | 10-15 | Fe(NO3)2, Cu(NO3)2, Zn(NO3)2, Mn(NO3)2, Ca(NO3)2, Ni(NO3)2, Co(NO3)2, CaCl2 |
Опыт 4. Гемолиз эритроцитов крови человека.
В три пробирки беру: в первую 2 мл 0,2% раствора NaCl, во вторую 1 мл 0,9% раствора NaCl, в третью 2 мл 0,9% раствора NaCl. в каждую из пробирок вносят по одной капле крови, полученной из пальца с помощью стерильной медицинской иглы и соблюдения всех мер стерилизации пальца.
После добавления крови все три пробирки встряхивают и оставляют на 30 мин. Через полчаса из каждой пробирки, с помощью стеклянной палочки, отбирают на предметные стёкла по одной капле крови. Закрывают капли покровными стёклышками и рассматривают в биологический микроскоп эритроциты крови сначала под малым увеличением, а затем под большим. Зарисовывают результаты наблюдения и дают пояснения в виде чёткого вывода.
Отчёт о работе
1. Зарисовать схему осмометра.
2. Вычислить с помощью осмометра и рассчитать осмотическое давление по формуле для исследованного раствора. Объяснить разницу в результатах.
3. Записать все химические реакции, которые имели место в опытах 2 и 3. Объяснить наблюдаемые явления.
4. Зарисовать форму эритроцитов крови человека в изотоническом и гипертоническом растворах. Объяснить наблюдаемые явления.
Работа 3
Буферные растворы
4 часа
Цель работы:
1. Научиться составлять буферные смеси с заданным рН.
2. Изучить некоторые свойства буферных систем.
План занятия
1. Сдача теоретического минимума (допуска) к работе.
2. Изучение свойств буферных растворов.
3. Составление отчета о работе.
Основная литература
1. Зимон А.Д. Физическая химия. Изд. 3-е. М.: Агар, 2006. – с. 92-95.
2. Зимон А.Д. Коллоидная химия. Изд. 5-е. М.: Агар, 2007. – с. 124-130.
Дополнительная литература
1.Болдырев А.И. Физическая и коллоидная химия, - М.: Высшая школа,2003.
2.Климов И.,И., Филько А. И. Сб. вопросов и задач по физической и коллоидной химии.- М.: Просвещение,2003.
3.Ленский А.С. Введение в бионеорганическую и биофизическую химию.- М.: Высшая школа, 1989.
4. Чанг Р. Физическая химия с приложениями к биологическим системам. - М.: Мир, 1990.
Вопросы для самоподготовки:
1. Применим ли ЗДМ к сильным электролитам? Как это подтверждается экспериментально? Напишите уравнения диссоциации уксусной, бензойной, серной и азотной кислот. Дайте необходимые пояснения.
2. Что называется степенью электролитической диссоциации? Истинная и кажущаяся степени диссоциации. К каким электролитам применимы эти понятия?
3. Что такое рН? Какие значения он принимает в кислой, нейтральной и щелочной средах?
4. Как изменится рН раствора, если к нему добавить раствор щелочи? Как нужно изменить концентрацию ионов водорода в растворе, чтобы рН его уменьшился?
5. Как изменится степень диссоциации слабого электролита при добавлении к его раствору сильного электролита с одноименным ионом? Приведите примеры и обоснуйте ответ использовав ЗДМ.
6. Какие растворы (смеси) называются буферными? Из каких веществ они могут быть составлены? Ответ подтвердите примерами.
7. Какими свойствами обладают буферные смеси? Почему разбавление и добавление к буферному раствору небольших количеств сильной кислоты или сильной щелочи ( в пределах буферной емкости) почти не изменяет его рН? Ответ подтвердить примерами и уравнениями реакций.
8. Что такое буферная емкость? От чего она зависит? Как она определяется опытным путем?
9. Как изменится рН и буферная емкость раствора при увеличении в одинаковой мере концентрации соли и кислоты?
10. Рассчитать рН буферного раствора составленного из 10 мл 0,1 М раствора уксусной кислоты и 5 мл 0,2 М раствора ацетата натрия.
11. Определить количество 0,2 М раствора уксусной кислоты, которое следует прибавить к 40 мл 0,1 М раствора ацетата натрия, чтобы получить буферный раствор со значением рН=4,4.
Краткие методические рекомендации
Приступая к выполнению опытов по изучению свойств буферных смесей необходимо иметь четкие теоретические понятия о составе буферных растворов и механизме их действия. Каждый опыт должен завершатся четко сформулированным выводом подтверждающим свойства буферных смесей. Там, где это возможно, необходимо написать соответствующие уравнения химических реакций или привести формулу, которая подтверждает ваш вывод.
Принадлежности для работы: Штатив для пробирок; семь пробирок две градуированные пробирки на 2 мл; 0,1 и 1 М растворы уксусной кислоты и ацетата натрия; 0,1 М растворы HCl и NaOH; физиологический раствор (0,9% р-р NaCl); универсальный индикатор с цветной шкалой для него; растворы метилового оранжевого и фенолфталеина.
Ход работы:
Опыт 1. Приготовление буферных смесей.
В семь одинаковых пробирок наливают при помощи градуированной пипетки или бюретки растворы 0,1 М растворы уксусной кислоты и ацетата натрия в объемах, указанных в таблице3
Таблица 3
| № пробирки | |||||||
| Объем кислоты, мл Объем раствора соли, мл Значение рН, найденное в опыте Значение рН вычисленное | 9,8 0,2 | 1,0 | 1,5 8,5 | 0,2 9,8 |
Размешав растворы в пробирках, добавляют к каждому из них по 3 капли универсального индикатора или опускают и смачивают универсальную индикаторную полоску и снова взбалтывают. Растворы или полоски универсальной бумаги окрашиваются в различные цвета. Сравнивая цвета полосок с цветной шкалой определяют примерное значение рН приготовленных буферных смесей. Точную концентрацию ионов водорода, а затем и рН рассчитывают по формулам:
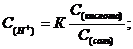
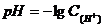
Величину К (константу диссоциации уксусной кислоты) принимают равной 1,85·10-5. Сравнивают значение рН найденное в опыте и рассчитанное по формулам. Делают вывод о точности определения рН с помощью универсального индикатора или индикаторной бумаги.
Опыт 2. Разбавление буферных смесей.
Приготавливают в трех колбах по 10 мл буферного раствора, взяв растворы кислоты и соли в тех состояниях, какие в пятой пробирке описанного выше опыта.
Раствор в первой колбе разбавляют дистиллированной водой в два раза, во второй - в три раза. Раствор в третьей колбе не разбавляют. Берут по 10 мл каждого раствора и прибавляют к каждому из них по 3 капли универсального индикатора. Окраска трех растворов будет одинакова, следовательно, рН от разбавления не изменяется.
Опыт 3. Действие кислот и щелочей.
В пробирку, содержащую раствор с наибольшим значением рН (из опыта «Приготовление буферных смесей»), приливают по каплям 0,1 М раствор хлороводородной кислоты. Цвет раствора практически не изменяется.
В пробирку с раствором, имеющим наименьшее значение рН, приливают по каплям 0,1 М раствор гидроксида. Цвет раствора практически не изменяется.
Опыт 4. Наливают в пробирку 12,5 мл 1 М раствора уксусной кислоты, 0,5 мл 1 М раствора ацетата натрия и 2-3 капли индикатора (метиловый оранжевый).
В другую пробирку наливают 13 мл физиологического раствора(0,9%) хлорида натрия и 2-3 капли того же индикатора, затем по каплям добавляют к данному раствору 0,01 М раствора хлороводородной кислоты до тех пор, пока характер окраски не станет таким же, как ацетатной смеси. После этого в каждую пробирку (с ацетатной смесью и физиологическим раствором) добавляют по 2-5 капель 0,1 М раствора гидроксида натрия и наблюдают изменение окраски буферной смеси и физиологического раствора.
Опыт 5. Буферная емкость.
В конической колбе приготавливают буферную смесь из 7 мл 0,1 М раствора CH3COOH и 3 мл 0,1 М раствора CH3COONa,прибавляют три капли универсального индикатора и при помощи цветной таблицы для универсального индикатора определяют значение рН приготовленной буферной смеси. Затем титруют буферный раствор 0,1 М раствором NaOH до едва заметного изменения окраски и записывают объем в миллилитрах NaOH, затраченных на титрование.
Опыт 6. Точно так же приготавливают другую буферную смесь на 3 мл 0,1 М раствора CH3COOH и 7 мл 0,1 М раствора CH3COONa.К смеси прибавляют три капли универсального индикатора и, как в первом случае, титруют тем же раствором NaOH до едва заметного изменения окраски. Записывают объем щелочи, затраченный на титрование.
Сравнивают результаты первого и второго титрования. Делают вывод о величине буферной емкости.
Опыт 7.Определение буферной емкости почвенной вытяжки. Важной характеристикой почв является их буферная емкость (буферность), о чем в некоторой степени можно судить по буферности почвенных вытяжек. В водных почвенных вытяжках содержатся карбонаты, фосфаты и частично белки(растворимая часть почв),наличие которых определяет буферность водных почвенных вытяжек.
Опыт 8. 20 г сухой почвы и 100 мл дистиллированной воды вносят в коническую колбу и встряхивают содержимое колбы в течение 3 минут. Затем фильтруют через складчатый фильтр и определяют рН фильтрата полоской универсальной лакмусовой бумаги. В две сухие плоскодонные колбы отмеривают по 20 мл почвенной вытяжки. В первую колбу добавляют две капли фенолфталеина и титруют 0,1 М раствором NaOH до появления слабо-малинового окрашивания. Во вторую колбочку с фильтратом добавляют 2-3 капли метилового оранжевого и титруют 0,1 М раствором HCl до появления слабо-розового окрашивания. Буферную емкость вычисляют по формуле:
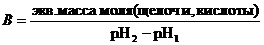
Для сравнения выполняют такой же опыт с безбуферным раствором, приготовленным из воды с добавлением к нему щелочи или кислоты до достижения такой же величины рН, как и у почвенной вытяжки.
Примечание. Рассчитать количество эквивалентных масс щелочи и кислоты, израсходованных на титрование 1 л. Буферного раствора можно по формуле:
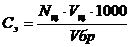 ; где
; где
Nщ -нормальность щелочи (или кислоты)
Vщ -объем раствора щелочи (или кислоты)израсходованный на титрование буферного раствора, в мл.(почвенной вытяжки)
Vбр- объем буферного раствора взятого для титрования(20 мл)
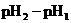 считать равной единице
считать равной единице
Отчет о работе
Сформулировать и записать выводы по каждому проделанному опыту.
