Опыт 1. Изучение электрической проводимости растворов
А. Запишите наблюдения, отмечая степень накала лампы:____________________________
____________________________________________________________________________________.
Напишите уравнение диссоциации воды:
H2O _______________________________________________________________________________.
Б. Запишите наблюдения, отмечая степень накала лампы:
1.___________________________________________________________________________________
2.___________________________________________________________________________________
3. __________________________________________________________________________________
4.___________________________________________________________________________________
5. ___________________________________________________________________________________
6. __________________________________________________________________________________.
Напишите уравнения диссоциации электролитов:
1. CH3COOH _________________________________________________________________________
2. NH4OH ____________________________________________________________________________
3. HNO3 _____________________________________________________________________________
4. HCl _______________________________________________________________________________
5. NaOH _____________________________________________________________________________
6. KOH ____________________________________________________________________________.
Вывод: (по степени накала лампы определить сильным или слабым электролитом являются вышеприведённые вещества)________________________________________________________________
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
В. Напишите уравнения реакций в молекулярной и ионной формах:
1. HCl + NaOH _______________________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________
2. CH3COOH + NH4OH _______________________________________________________________.
_________________________________________________________________________________________________________________________________________________________________________.
Смешайте равные объёмы растворов и запишите наблюдения:
1.___________________________________________________________________________________
2.___________________________________________________________________________________,
Вывод: (какова электрическая проводимость полученных растворов)_________________________
____________________________________________________________________________________
___________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________.
Опыт 2. Зависимость электрической проводимости раствора (степени диссоциации электролита) от разбавления
При добавлении дистиллированной воды к концентрированной кислоте степень накала лампы ______________________________________________________________________________.
При добавлении дистиллированной воды к концентрированному раствору аммиака степень накала лампы ________________________________________________________________________.
Вывод:(как изменяется электрическая проводимость растворов от разбавления)____________________
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
Опыт 3. Изменение электрической проводимости раствора в результате смещения ионного равновесия
Напишите уравнение диссоциации серной кислоты:
H2SO4 _______________________________________________________________________________
Степень накала лампы 0,02 М раствора серной кислоты ____________________________________.
Напишите уравнение диссоциации гидроксида бария:
Ba(OH)2 ____________________________________________________________________________.
Степень накала лампы 0,02 М раствора гидроксида бария______________________________
При добавлении фенолфталеина к раствору гидроксида бария раствор окрашивается в___________________цвет. При добавлении серной кислоты к гидроксиду бария цвет раствора_______________________, а степень накала лампы_________________________. В момент исчезновения окраски индикатора (в точке эквивалентности) электрическая проводимость раствора_________________________________________________________ .
Напишите ионообменную реакцию в молекулярной и ионной формах:
H2SO4 + Ba(OH)2_________________________________________________________________
_____________________________________________________________________________________
____________________________________________________________________________________.
При добавлении к раствору избытка серной кислоты электрическая проводимость раствора_______________________________________________________________________.
Вывод:(как изменяется электрическая проводимость при связывании ионов)______________________
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
Опыт 4. Влияние одноименного иона на степень диссоциации слабого электролита (смещение равновесия диссоциации)
А. Напишите уравнения диссоциации:
NH4OH ______________________________________________________________________________
NH4Cl _____________________________________________________________________________________
КД (NH4OH) = ______________________________.
При добавлении фенолфталеина к раствору аммиака наблюдается _______________________окрашивание. В присутствии хлорида аммония цвет раствора __________________________.
Вывод:(как изменяется степень диссоциации слабого электролита исходя из принципа Ле Шателье и константы диссоциации)__________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________.
Б. Напишите уравнения диссоциации
CH3COOH ___________________________________________________________________________
CH3COONa __________________________________________________________________________
КД (CH3COOH) =
_____________________________________________________
При добавлении метилового оранжевого к раствору уксусной кислоты наблюдается _______________окрашивание. В присутствии ацетата натрия цвет раствора ___________________ ___________________________________________________________________________________.
Вывод:(как изменяется степень диссоциации слабого электролита исходя из принципа Ле Шателье и константы диссоциации)___________________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ФГБОУ ВПО «Уфимский государственный нефтяной технический университет»
Кафедра «Прикладная химия и физика»
Дисциплина «Химия»
ОТЧЕТ
по лабораторной работе №3
На тему: «Приготовление водных растворов»
Выполнил
студент группы БВВ-12-01 ______________ Трясцина Д.В.
(Подпись, дата)
Принял
преподаватель кафедры ПХиФ ______________ Сухарева И.А.
(Подпись, дата)
Цель работы:
-освоить навыки приготовления растворов заданной концентрации и методики их количественного анализа.
Теоретическая часть
Количественный состав растворов выражается концентрацией. Концентрацией раствора называется___________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________.
Массовая доля растворённого вещества – ___________________________________________
___________________________________________________________________________________
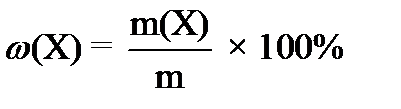 ,
,
где ω (Х) – ____________________________________________________________________
m(X) –______________________________________________________________________________ m – ________________________________________________________________________________.
Молярная концентрация - ________________________________________________________
____________________________________________________________________________________
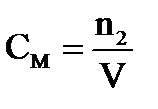
где n2 – _________________________________________________________________________
V − ________________________________________________________________________________.
Нормальная концентрация - _____________________________________________________
_____________________________________________________________________________________
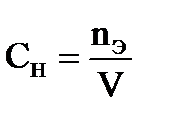
где nЭ – _________________________________________________________________________
V − ________________________________________________________________________________.
Моляльная концентрация – _______________________________________________________
_____________________________________________________________________________________
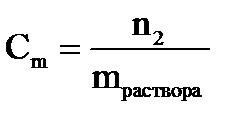
где n2 – __________________________________________________________________________
mраствора − ____________________________________________________________________________.
Мольная доля – ______________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________
Экспериментальная часть
