Классификация химических соединений ,закномоерность протекания химических реакций
Билет 1
1.1Атом - наименьшая, химически неделимая часть химического элемента. Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженныхпротонов и незаряженных нейтронов.
Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Материя не может существовать вне движения, она всегда находится в состоянии движения, изменения и развития. При уничтожении движения объект прекращает свое существование, переходит в другие объекты, которым характерно движение покоя – состояния движений, обеспечивающих стабильность предмета, сохраняя его качества. Покой относителен, а движение абсолютно – это неотъемлемое свойство материи.
Материя не существует без движения, так же как движение не существует без материи.
Движение материи– постоянное ее взаимодействие, а также изменения состояния объектов, вызванные этими взаимодействиями. Формы движения материи различны. Пример формы движения материи: нагревание и охлаждение тел, излучение света, электрический ток, химические и физические превращения, жизненные процессы. Классификация форм движения материи :
1) неживая природа;
2) живая природа;
3) общество.
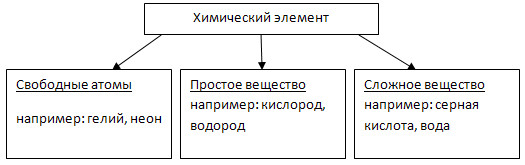
Свободными называют атомы, которые не имеют химической связи с другими атомами. Большинство простых веществ, образованных одним химическим элементом, состоят из химически связанных, т. е. не свободных атомов.
Пример свободных атомов, которые могут существовать сколько угодно долго - это благородные газы гелий, неон, аргон, криптон, ксенон. Отдельные атомы других химических элементов в свободном состоянии не могут существовать долго из за высокой реакционной способности.
Простые вещества – это вещества, образованные атомами одного и того же химического элемента.
Вещества, образованные из двух и более химических элементов, называются сложными.
Химическая промышленность преследует цель снабдить народное хозяйство различными веществами, материалами, продуктами, получаемыми ею путем изменения состава или структуры исходных веществ, т. е. химическими способами.
Химизация народного хозяйства — это внедрение химических методов обработки материалов и продуктов химической промышленности во все отрасли производства, культуры и быта.
1.2
1) CaCO3+2HCl=CaCl2+H2O+CO2 (мрамор или известняк + кислота)
2) CO2+Ca(OH)2=CaCO3+H2O (известковая вода - раствор гидроксида кальция)
3) CO2+CaCO3+H2O=Ca(HCO3)2 (гидрокарбонат кальция - заметно растворимая соль)
4) Ca(HCO3)2 ---> CaCO3+H2O+CO2 (гидрокарбонат кальция - очень неустойчива, как все гиддрокарбонаты, и легко распадается при нагревании на основную соль и CO2, CaCO3 вновь выпадает в осадок)
1.3 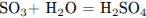
Рассчитаем массу серной кислоты, находившейся в исходном растворе и получившейся из х моль
оксида серы (VI):
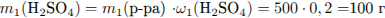
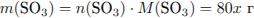 (где х - число молей оксида серы)
(где х - число молей оксида серы)
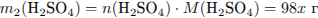
Рассчитаем массу раствора и суммарную массу серной кислоты в нём:
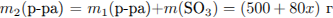
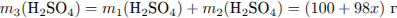
Найдем массу SO3 , необходимую для растворения:
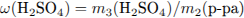
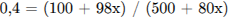
Откуда 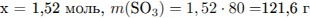
Билет 2
2.1
Квантовые числа –энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квантовое число(n)определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начинаю с 1 (n= 1, 2, 3…).
Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. Набор орбиталей с одинаковыми значениями n называется энергетическим уровнем, c одинаковыми n и l - подуровнем.
Магнитное квантовое число(m) характеризует положение электроннойорбитали в пространстве и принимает целочисленные значения от -I до +I, включая 0. Это означает, что для каждой формы орбитали существует (2l + 1) энергетически равноценных ориентации в пространстве.
Для s- орбитали (l = 0) такое положение одно и соответствует m = 0. Сфера не может иметь разные ориентации в пространстве.
Для p- орбитали (l = 1) - три равноценные ориентации в пространстве (2l + 1 = 3): m = -1, 0, +1.
Для d- орбитали (l = 2) - пять равноценных ориентаций в пространстве (2l + 1 = 5): m = -2, -1, 0, +1, +2.
Таким образом, на s- подуровне - одна, на p- подуровне - три, на d- подуровне - пять, на f- подуровне - 7 орбиталей.
Спиновое квантовое число (s) характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и –1/2 соответствующие противоположным направлениям вращения.
Энергетический уровень — это совокупность орбиталей, которые имеют одинаковые значения главного квантового числа. Число энергетических уровней атома равно номеру периода, в котором он расположен. Например,калий(К) -элемент четвертого периода, имеет 4 энергетических уровня (n = 4).
Энергетический подуровень — совокупность орбиталей с одинаковыми значениями главного и орбитального квантовых чисел. Энергетический подуровень обозначается латинскими буквами: s, p, d, f и т. д. Например, n = 2,1 = 0,1. Значит, на 2 уровне есть подуровень s (1 = 0) и подуровень р (1 = 1).
1. Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, m, s) были бы одинаковы, т.е. на каждой орбитали может находиться не более двух электронов (c противоположными спинами).
2. Правило Клечковского (принцип наименьшей энергии). В основном состоянии каждый электрон располагается так, чтобы его энергия была минимальной. Чем меньше сумма (n + l), тем меньше энергия орбитали. При заданном значении (n + l) наименьшую энергию имеет орбитальс меньшим n. Энергия орбиталей возрастает в ряду:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d > 4f < 6p < 7s.
3. Правило Хунда. Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
Запись, отражающая распределение электронов в атоме химического элемента по энергетическим уровням и подуровням, называется электронной конфигурацией этого атома. В основном (невозбужденном) состоянии атома все электроны удовлетворяют принципу минимальной энергии. Это значит, что сначала заполняются подуровни, для которых:
1) Главное квантовое число n минимально;
2) Внутри уровня сначала заполняется s- подуровень, затем p- и лишь затем d-подуровень;
3) Заполнение происходит так, чтобы (n + l) было минимально (правило Клечковского);
4) В пределах одного подуровня электроны располагаются таким образом, чтобы их суммарный спин был максимален, т.е. содержал наибольшее число неспаренных электронов (правило Хунда).
5) При заполнении атомныхорбиталей выполняется принцип Паули. Его следствием является, что энергетическому уровню с номером n может принадлежать не более чем 2n 2 электронов, расположенных на n 2 подуровнях.
2.2
При электролизе расплава соли на катоде выделяется металл (уравнение 1). При горении натрия преимущественно образуется пероксид натрия (уравнение 2), который реагируете углекислым газом с выделением кислорода (уравнение 3). При нагревании раствора, содержащего NH4Cl (соль, образованная слабым основанием и сильной кислотой) и Na2C03 (соль, образованная сильным основанием и слабой кислотой), будет происходить гидролиз (уравнение 4).

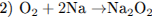
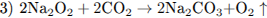
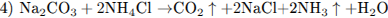
2.3
Билет 3.1

3.2
1) P₄ + 3KOH (конц.) + 3H₂O = 3KH₂PO₂ + PH₃ (газ)
2) 2PH₃ + 4O₂ = P₂O₅ + 3H₂O
3) P₂O₅ + 4NaOH = 2NaHPO₄ + H₂O
4) 2Na₂HPO₄ = Na₄P₂O₇ + H₂O
3.3
CaCO3 + 2HNO3 =Ca(NO3)2 + H2O + CO2
Состав конечного раствора после добавления CaCO3:
1. Н2О - она будет состоять из воды начального раствора азотной кислоты + вода образовавшияся в результате реакции
2. Ca(NO3)2 - образовавшийся в результате реакции
3. HNO3 - количество уменьшится на количество прореагировавшей с CaCO3 кислоты
Обозначим количество моль прореагировавшей кислоты через Х, концентрация кислоты в конечном растворе составляет 10/2=5%
4. Масса 1 моль HNO3=1+14+3*16=63 г
Масса 1 моль Ca(NO3)2=40+(14+3*16)*2=164 г
Масса 1 моль воды = 2*1+16=18 г
Масса 1 моль CaCO3= 40+12+3*16=100 г
5. Составим уравнение
(250*0,1-63*х) /(250+164*х/2+18*х/2-63*х=0,05
Решая уравнение получим 64,4*х=12,5, т. е. х=0,1941 моль HNO3 прореагировали в результате реакции.
По уравнению реакции количество моль CaCO3 реагирущее с 2 моль HNO3 равно 1, следовательно масса карбоната кальция, которое необходимо для получения 5% конечноного раствора азотной кислоты= 0,1941/2*100=9,705 г
Билет 4
Тепловой эффект
Химическая реакция-разрыв связи продуктов реакции и образование новых связей в продуктах реакции
Химическая реакция- процесс превращения веществ связанных с превращением энергии, сопровождающейся образованиями новых веществ с другими свойствами
Признаки классификации
1.Число и состав исходных и образующих веществ
· Соединение
· Разложение
· Замещение
· Обмен
2. Тепловой эффект реакции
· Экзотермический (выделение теплоты)
· Эндотермический (поглащение теплоты
3. По степени окисления
· ОВР
· Не ОВР
4. Обратимость
· Обратимые
· Не обратимые
5.Наличие катализатора
· Каталитические
· Не каталитические
6. По агрегатному состоянию
· Гомогенные
· Гетерогенные
Термохимическое уравнение
Раздел химии в котором изучается тепловой эффект реакции называется термохимией
Тепловой эффект- это теплота, которая может быть поглощена или выделена
Термохимия- Q,Термодинамика ∆H-энтальпия
Стандартной энтальпией образования вещества называется количество теплоты, которое выделяется или поглощается при образовании одного моля этого вещества из простых веществ при стандартных условиях
Тепловой эффект реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов называется теплотой сгорания этого вещества
Энтальпия –функция состояния
Билет 5
5.1Типы химической связи
Основные типы химической связи - ионная, ковалентная и водородная .
Ионная (электровалентая) Она образуется при взаимодействии атомов, которые сильно отличаются по электроотрицательности. В этом случае происходит переход валентных электронов от атомов с меньшей электроотрицательностью к атомам, у которых она больше. В результате такого перехода возникают два противоположно заряженных иона - катион и анион, которые взаимно притягиваются друг к другу. Наиболее типичной ионной связью является связь между металлами и галогенами. Для органических соединений наиболее характерными являются ковалентная и водородная связи.
Ковалентная (неэлектровалентная) связь - основная химическая связь в органических соединениях. Этот тип связи образуется при взаимодействии атомов, электроотрицательности которых равны или отличаются незначительно. Такая связь возникает в результате обобществления валентных электронов, которые до образования связи принадлежали двум атомам. В результате образования молекулы оба электрона становятся общими для двух ядер. Так образуется единое электронное облако - молекулярнаяорбиталь.
КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) - образуют атомы одного и того же химического элемента - неметалла (Например, H2, O2, О3).
КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) - образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl, H2O).
Водородная связь. (H-связь) Ее образование обусловлено тем, что в результате сильного смещения электронной пары от электроотрицательного атома водорода, обладающей эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20-100 кДж моль-1.
Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при -100°С, а кипела при -80°С.
Металлическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
Металлическая связь отличается от ковалентной также и по прочности: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Энергия связи — энергия, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества. Энергии ковалентных и ионных связей обычно велики и составляют величины порядка 100-800 кДж/моль.
МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ, взаимод, молекул между собой, не приводящее к разрыву или образованию новых хим. связей. Межмолекулярное взаимодействие определяет отличие реальных газов от идеальных, существование жидкостей и мол, кристаллов. От межмолекулярного взаимодействия зависят мн. структурные, спектральные, термодинамич., теплофиз. и др. св-ва в-в. Появление понятия межмолекулярного взаимодействия связано с именем Й. Д. Ван-дер-Ваальса, к-рый для объяснения св-в реальных газов и жидкостейпредложил в 1873 ур-ние состояния, учитывающее межмолекулярное взаимодействие (см. Ван-дер-Ваальса уравнение). Поэтому силы межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми.
Виды межмолекулярного взаимодействия.Основу межмолекулярного взаимодействия составляют кулоновские силы взаимод, между электронами и ядрами одной молекулы и ядрами и электронами другой. В экспериментально определяемых св-вах в-ва проявляется усредненноевзаимод., к-рое зависит от расстояния R между молекулами, их взаимной ориентации, строения и физ. характеристик (ди-польного момента, поляризуемости
и др.). При больших R, значительно превосходящих линейные размеры l самих молекул, вследствие чего электронные оболочки молекул не перекрываются, силы межмолекулярных взаимодействий можно достаточно обоснованно подразделить на три вида-электростатические, поляризационные (индукционные) и дисперсионные. Электростатич, силы иногда называют ориентационными, однако это неточно, поскольку взаимная ориентация молекул может обусловливаться также и поляризац, силами, если молекулы анизотропныКристаллические решетки. Атомные, молекулярные и ионные кристаллы. Зависимость физических свойств веществ от типов кристаллических решеток
В кристаллических веществах атомы, молекулы и ионы расположены упорядоченно, на определенных расстояниях. Такое закономерное расположение частиц в кристаллах называют кристаллической решеткой. Зависимости от того, какие частицы находятся в узлах этой решетки, различают ионные, атомные и молекулярные кристаллические решетки. Известны также и металлические кристаллические решетки.
Ионные кристаллические решетки характерны для соединений с ионным типом химической связи. В узлах таких решеток находятся противоположно заряженные ионы. Силы мижионнои взаимодействия являются весьма значительными, поэтому вещества с таким типом кристаллической решетки является нелетучими, твердыми, тугоплавкими, их растворы и расплавы проводят электрический ток. Типичными представителями таких соединений являются соли, например, натрия хлорид, калия нитрат и другие.
5.2При взаимодействии азота и лития образуется нитрид лития (уравнение 1), который легко разлагается водой с выделением аммиака (уравнение 2). Аммиак окисляется кислородом в присутствии платинового катализатора до оксида азота (II), не имеющего цвета (уравнение 3). Образование бурого газа NO2 из NO происходит легко и самопроизвольно (уравнение 4).
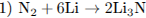

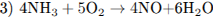
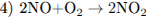
5.3
Билет 6
1.Дипольный момент – важная молекулярная константа, характеризующая электрическую симметрию молекулы.
Знание величины дипольного момента необходимо для изучения природы химической связи, оценки прочности донорно-акцепторных и межмолекулярных связей, для квантово-химических расчетов. По величине дипольного момента можно судить об изомерии и конформации органических соединений, конфигурации координационных узлов комплексов, о взаимном влиянии атомов и связей в молекуле.
Степень ионности – это реальный заряд тона в крист-й структуре.
Величина ионности может быть оценена и по разности электроотрицательностей атомов.
Насыщаемость– свойство атомов образовывать строго определенное число ковалентных связей. Благодаря насыщаемости связей молекулы имеют определенный состав.
Направленность– т. е. связь образуется в направлении максимального перекрытия электронных облаков. Относительно линии соединяющей центры атомов образующих связь различают: σ и π (рис. 9):
σ-связь – образована перекрыванием АО по линии соединяющей центры взаимодействующих атомов; π-связь – это связь, возникающая в направлении оси перпендикулярной прямой, соединяющей ядра атома.
Направленность связи обусловливает пространственную структуру молекул, т. е. их геометрическую форму.
Длинной связи d называют расстояние между центрами атомов, образующих данную связь. Экспериментальные методы позволили найти точную длину связей. Они имеют величину порядка 100 пм.
Например:
Н = 74 пм;
N2 = 110 пм;
О2 = 121 пм;
(С – С) = 154-158 пм;
(С = С) ≈ 134 пм;
(С ≡ С) ≈ 120 пм.
Определяют длину рентгеноструктурно и спектрально. Длина связи увеличивается с возрастанием атомного номера. При переходе от газов к кристаллам наблюдается увеличение длины связи, которое сопровождается её упрочнением. Длина связи позволяет также оценить жесткость связи, т.е. её сопротивляемость внешним воздействиям, вызывающем её длины.
Энергия связи
Мерой прочности связи является энергия связи. Её величина определяется работой, необходимой для разрушения связи, или выигрышем в энергии при образовании вещества из отдельных атомов.например, энергия связи Н-Н в молекуле Н2 = 435 кДж/моль (104 ккал/моль), это значит, что при образовании 1 моля Н2 выделяется 435 кДж (104 ккал).
Н + Н = Н2 + 435 кДж/моль (104 ккал/моль)
Аналогичным путем можно оценить энергию химической связи и для других двухатомных молекул.
из свободных атомов:
clip_image002
из простых веществ:
clip_image004
Эти данные позволяют оценить прочность связи:
С – С (85 ккал);
С = С (145 ккал);
С ≡ С (198 ккал).
Таким образом параметры связи – это энергия, длина, валентные углы, прочность, насыщаемость, направленность.
6.22KMnO4 + 16HBr = 2MnBr2 + 5Br2 + 8H2O + 2KBr
3Br2 + 2Fe = 2FeBr3
FeBr3 + 3CsOH = Fe(OH)3 + 3CsBr
2Fe(OH)3 = Fe2O3 + 3H2O
6.3Решение
Найдем массу селеновой кислоты в растворе:
100*0,15=15г
127*Хг------------145*Хг
SеO3+Н2О=H2SеO4
127г-------------145г
Пусть нам нужно добавить Х моль SеO3 (его масса будет 127*Х г), тогда в растворе образуется 145Х г H2SеO4. По условию нам нужно получить 30% (или 0,3 ) раствор, значит:
(15+145*Х)/(100+127*Х)=0,3
Х=0,14моль
Откуда 127*Х=17,8 г это ответ
БИЛЕТ №7
7.1.Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Термохимические уравнения – это уравнения, в которых указан тепловой эффект (изменение энтальпии Н) реакции и физическое состояние реагентов и продуктов.
Расчеты по термохимическим уравнениям (экзотермические, эндотермические реакции, тепловой эффект)
1. Составьте термохимическое уравнение реакции горения магния, если известно, что при
2. Вычислите по термохимическому уравнению количество теплоты, выделяемой при сгорании
3. По термохимическому уравнению Вычислите массу разложившегося в-ва , если известно, что на его разложение затрачено
7.2
FeS+2HCl=FeCl2+H2S
2Н2S+3O2=2SO2+2H2O
SO2+2KOH=K2SO3+H2O
K2SO3+2KMnO4+2KOH=K2SO4+2K2MnO4+H2O в щелочной среде реакция так протекает!
7.3
CaC2 + 2H2O = Ca(OH)2 + C2H2
Ca(OH)2 + 2HBr = CaBr2 + 2H2O
n(CaC2) = 6,4/64 = 0,1 моль.
m(HBrчистого) = V*p*w = 87*1,12*0,20 = 19,49 г.
Изуравненияреакцииследует, что n(CaC2) = n(Ca(OH)2) = n(C2H2), атакжечто n(HBrпрореагировавшего) = 2n(Ca(OH)2) = 0,2 моль.
Тогда
m(HBr прореагировавшего) = n*Mr = 0,2*81 = 16,20 г.
m(HBr осталось) = 19,49 - 16,20 = 3,29 г.
m(C2H2) = n*Mr = 0,1*26 = 2,6 г.
m(полученного раствора) = m(раствора кислоты) + m(CaC2) - m(C2H2) = 87*1,12 + 6,4 - 2,6 = 101,24 г.
w(HBr оставшегося) = (3,29/101,24)*100% = 3,25%.
Ответ: массовая доля бромоводорода в образовавшемся растворе составляет 3,25%.
Билет 8
8.1 Тепловой эффект реакции,теплота, выделенная или поглощенная термодинамической системой при протекании в ней химической реакции. Определяется при условии, что система не совершает никакой работы (кроме возможной работы расширения), а температуры реагентов и продуктов равны. Поскольку теплота не является функцией состояния, т.е. при переходе между состояниями зависит от пути перехода, то в общем случае тепловой эффект реакции не может служить характеристикой конкретной реакции. В двух случаях бесконечно малое количество теплоты (элементарная теплота) dQ совпадает с полным дифференциалом функции состояния: при постоянстве объема dQ = = dU (U-внутренняя энергия системы), а при постоянстве давления dQ = dH (H-энтальпия системы).
Термохимические уравнения реакций - это уравнения, в которых около символов химических соединений указываются агрегатные состояния этих соединений или кристаллографическая модификация и в правой части уравнения указываются численные значения тепловых эффектов.
Алгоритм расчетов по химическим уравнениям
1.Составить уравнение химической реакции.
2.Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3.Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4.Составить и решить пропорцию.
5.Записать ответ.
8.2
FeS+2HCl=FeCl2+H2S
2Н2S+3O2=2SO2+2H2O
SO2+2KOH=K2SO3+H2O
K2SO3+2KMnO4+2KOH=K2SO4+2K2MnO4+H2O
8.3
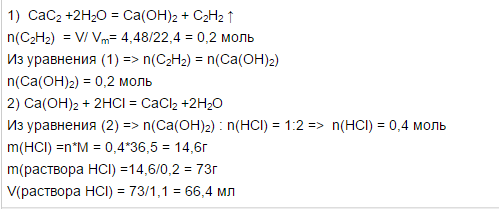
БИЛЕТ№9
9.1Химическая кинетика –это раздел химии, в котором изучается скорость и механизм хим.реакции.Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Скорость гомог.р-ции-изменение кол-ва вещества, вступившего или образующего в результате реакции за единицу времени в единице объема системы. Скорость гет-ой р-ции-изменение кол-ва в-ва за единицу времени на единицу поверхностного раздела фаз
З-н действующих масс– скорость хим.р-ции пропорционально произведению концентрации реагирующих в-в.
Правило Вант-Гоффа — При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
Катализизменение скорости химической реакции при воздействии веществ (катализаторов), которые участвуют в реакции, но не входят в состав продуктов. Катализатор не находится в стехиометрич, отношениях с продуктами и регенерируется после каждого цикла превращения реагентов в продукты
9.2
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4
2Fe(OH)3 =(t)= Fe2O3 + 3H2O
Fe2O3 + 6HCl = 2FeCi3 + 3H2O
9.3
Билет 10
10.1Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO 3 = 2KCl + 3O 2 ↑
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем. Необратимые и обратимые реакции.
Константа химического равновесия — характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие.
10.2
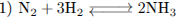
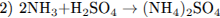
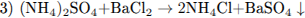
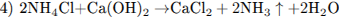
10.3
1) Уравнение р-ии: Al4C3 + 12HCl = 4AlCl3 + 3CH4|;
2) найдем массу HCl в р-ре: 550*0.1=55 г;
3) при уменьшении м.д. HCl в р-ре в 2 р. его м.д. сос-т 10%/2=5% или 0.05;
4) уменьшение м.д. HCl в р-ре обусловлено 2 факторами: а) расходом мол-л HCl в р-ии с Al4C3 и б) образ-м в рез-те р-ии мол-л AlCl3;
5) рассчитаем соот-ия масс Al4C3, HCl и AlCl3:
mAl4C3=1*144=144 г (x),
mHCl=12*36.5=438 г (y) и
mAlCl3=4*133.5=534 г (z), т.о. y=438/144=3.042*x, а z=534/144=3.7*x;
6) выражение для м.д. HCl выглядит так: (55-3.042*x)/(550-3.042*x+3.7*x)=0.05;
решая 6) находим х=8.9422 г;
Ответ: нужно добавить 8.9422 г Al4C3.
БИЛЕТ№11
11.1 Окислительно – восстановительные реакции- химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующихся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).
Виды окислительно–восстановительных реакций-1)межмолекулярная-окислитель и восстановитель входят в состав разных веществ.4Al+3O2-Al2O3.2)внутримолекулярная-окис-ль и вос-ль входят в состав 1-го вещества.2Cu(NO3)2-CuO+4NO2+O2.3)диспропроционирования-ок-ль и вос-ль идентичные атомы одного вещества(самоокисление и самовосстановление) . Cl2+2NaOH-NaO+NaClO+H2O.
Методы расстановки коэффициентов в ОВР.
1) метод электронного баланса (МЭБ);-1)подсчитать степень окисления каждого элемента2)записать уравнение с указанием вычисленных степеней окисления.3)выделить элементы ,степени которых изменились.4)составить элект.баланс.5)найти наименьшее общее кратное.6)вставить в уравнение найденные коэффиценты.
2) метод полуреакций.- 1. Определяем участников окислительно-восстановительного процесса.2)Выписываем участников овр в ионной форме.3) Уравниваем количество атомов.4) Определяем среду реакции.5) Уравниваем заряды.6) Теперь надо уравнять реакции восстановления и окисления между собой.7) Выписываем все реагенты с учетом коэффициентов и все продукты овр.8) Дописываем к каждому иону его “половинку” с учетом коэффициентов и сочетаем продукты реакции.9) Сокращаем одинаковые молекулы слева и справа.
11.2
11.3 MgCO₃ + H₂SO₄ = MgSO₄ + H₂O + CO₂
m(р-ра H₂SO₄) = 250 * 1,08 = 270 г
m(H₂SO₄ в р-ре) = 15 * 270 : 100 = 40,5 г
М(H₂SO₄) = 1 * 2 + 32 + 16 * 4 = 98 г/моль
n(H₂SO₄) = 40,5 : 98 = 0,413 моль
М(MgCO₃) = 24 + 12 + 16 * 3 = 84 г/моль
n(MgCO₃) = 8,4 : 84 = 0,1 моль
H₂SO₄ - в избытке, расчет ведем по MgCO₃
М(MgSO₄) = 24 + 32 + 16 * 4 = 120 г/моль
m(MgSO₄) = (8,4 * 120 * 1) : (84 * 1) = 12 г
М(СО₂) = 12 + 16 * 2 = 44 г/моль
m(СО₂) = (8,4 * 44 * 1) : (84 * 1) = 4,4 г m(р-ра) = 8,4 + 270 - 4,4 = 274 г
w%(MgSO₄) = 12 : 274 * 100 % = 4.38 %
БИЛЕТ№12
12.1
12.2. AlCl3 + 3NH4OH ->Al(OH)3+3NH4Cl
2Al(OH)3 (t)-> Al2O3 + 3H2O
Al2O3 + 2KOH + 3H2O->2K[Al(OH)4]
2K[Al(OH)4] + CO2 -> K2CO3 + 2Al(OH)3+ H2O
12.3 Реакция: Al4C3 + 12HCl = 4AlCl3 + 3CH4
Количество метана: n(CH4) = V/Vм = 6,72 л/22,4 л/моль = 0,3 моль. Его масса: m(CH4) = n*M=).3*16 = 4,8 г
Начальная масса хлороводорода: m1(HCl) = m1(р-ра) *w = 380 г*0,15 = 57 г
По уравнению реакции HCl затрачено в 4 раза больше, т. е. 1,2 моль.
Его масса: m2(HCl) = n*M= 1,2 моль*36,5 г/моль = 43,8 г. Остаток хлороводорода: 57 г-43,8 г = 13,2 г
Количество карбида алюминия - втрое меньше, чем метана, т. е. 0,1 моль.
Масса карбида: m(Al4C3) = n*M = 0,1 моль*156 г/моль = 15,6 г
Конечная масса раствора: 300 г + 15,6 г - 4,8 г = 310,8 г
Массовая доля хлороводорода в конечном р-ре: w(HCl) = 13,2 г/310,8 г = 0,0424, или 4,24%
БИЛЕТ№13
13.1 Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия.Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Вода как растворитель.
По отношению к воде все практически вещества можно разделить на две группы:
1. Гидрофильные (от греч. "филео" - любить, имеющие положительное сродство к воде) . Эти вещества имеют полярную молекулу, включающую электроотрицательные атомы (кислород, азот, фосфор и др.) . В результате отдельные атомы таких молекул также обретают частичные заряды и образуют водородные связи с молекулами воды. Примеры: сахара, аминокислоты, органические кислоты.
2. Гидрофобные (от греч. "фобос" - страх, имеющие отрицательное сродство к воде) . Молекулы таких веществ неполярны и не смешиваются с полярным растворителем, каковым является вода, но хорошо растворимы в органических растворителях, например, в эфире, и в жирах. Примером могут служить линейные и циклические углеводороды. в т. ч. бензол. Значение воды в промышленности, химводоочистка на нефтехимических предприятиях, охрана водных ресурсов. В структуре водоотведения 35% приходится на все отрасли промышленности, кроме теплоэнергетики, 33% - на теплоэнергетику, 18% состовляют сбросы стоков с мелиорированных полей и 14%- сбросы коммунально-бытового хозяйства городов и сельских населенных пунктов.
Одним из главных потребителей воды являетсяорошаемое земледелие - 190 м3/год. Чтобы вырастить 1 т. хлопка, требуется 4-5 тыс. м3 пресной воды, 1 т. риса - 8 тыс. м3 . При орошении большая часть воды расходуется безвозвратно. Водопотребление на орошение зависит от трех факторов: площадей полива, состава культур и техники полива.
13.2 2Fe+6H2SO4=Fe2(SO4)3+3SO2+6H2O
Fe2(SO4)3+6KOH=2Fe(OH)3+3K2SO4
2Fe(OH)3(t) = Fe2O3+3H2O
Fe2O3+Fe=3FeO
13.3 Дано:
m(раствора)=275 г
W%1=10%
W%2=15% (10*1,5)
Найти: m(CrO3)
m(H2CrO4)=275*10/100=27,5 г
CrO3 + H2O = H2CrO4
1 моль 1 моль
x моль х моль (по уравнению реакции 1:1)
М=100 г/моль М=118 г/моль
m=100х г m=118x г
m(H2CrO4)=27,5+118x г
m(раствора) = 275+100х г
Подставляем в формулу для расчета массовой доли
15% = (27,5+118х)*100%/(275+100х)
27,5+118х = 15х+41,25
103х = 41,25
х = 0,1335 моль оксида хрома нужно добавить для изменения концентрации в 1,5 раза
m(CrO3)=M*n = 100*0,1335 = 13,35 г
БИЛЕТ№14
14.1Количественные характеристики растворов: 1) массовая доля растворённого вещества, которая равна отношению массы растворённого вещества к массе раствора; 2) молярная концентрация, показывающая число молей растворённого вещества в 1 литре раствора.
14.2 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Элетролиз раствора Cu(NO3)2
А(+): 2 H2O - 4e ---> 4 H+ + O2 | 1 | - окисление
К(-): Сu2+ + 2e ---> Cu0 | 2 | - восстановление
2 Cu2+ + 2 H2O --эл. ток--> 2 Cu + 4 H+ + O2
2 Cu(NO3)2 + 2 H2O --эл. ток--> 2 Cu + 4 HNO3 + O2 2Na + O2 = Na2O2 Na2O2 + CO2 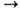 Na2CO3
Na2CO3
14.3 m1(H3PO4)p-pa = 1000 г
w1(H3PO4) = 50%
w2(H3PO4) = 75%
4P + 5O2 = 2P2O5 (1)
P2O5 + 3H2O = 2H3PO4 (2)
Масса чистого вещества ортофосфорной кислоты H3PO4 в первом растворе
Масса чистого вещества H3PO4 в первом растворе
m1(H3PO4) = [m1(H3PO4)p-pa*w1(H3PO4)]/100% = [1000*50]/100 = 500 г
Пусть для получения 75%-ного раствора ортофосфорной кислоты H3PO4 необходимо добавить х моль оксида фосфора (V) P2O5.
n(P2O5) = х моль
Масса растворенного оксида фосфора (V) P2O5
m(P2O5) = n(P2O5)*M(P2O5) = 142x г
Количество вещества и масса образовавшейся в результате реакции (2) ортофосфорной кислоты Н3РО4
n2(H3PO4) = 2n(P2O5) = 2x моль
m2(H3PO4) = n2(H3PO4)*M(H3PO4) = 2x*98 = 196x г
Масса чистого вещества H3PO4 во втором растворе будет складываться из первоначальной массы чистого вещества H3PO4 в первом растворе и массы H3PO4, образовавшейся в результате реакции (2)
m3(H3PO4) = m1(H3PO4) + m2(H3PO4) = (500 + 196x) г
Масса второго раствора будет складываться из первоначальной массы раствора H3PO4 и массы растворенного в нем оксида фосфора (V) P2O5.
m2(H3PO4)p-pa = m1(H3PO4)p-pa + m(P2O5) = (1000 + 142x) г
w2(H3PO4) = m3(H3PO4)/m2(H3PO4)p-pa = (500 + 196x)/(1000 + 142x) = 0,75
(500 + 196x) = 0,75*(1000 + 142x)
Решая уравнение, получим
n(P2O5) = х ≈ 2,8 моль
Согласно уравнению реакции (1) количество вещества фосфора, необходимое для получения 2,8 моль оксида фосфора (V)
n(P) = 2n(P2O5) = 2*2,8 = 5,6 моль
Масса фосфора
m(P) = n(P)*M(P) = 5,6*31 = 173,6 г
БИЛЕТ№15
15.1Элект.диссоциация-это распад электролита на ионы при его раствор<
