Сильные и слабые электролиты.
Электролитами наз-ся в-ва, проводящие электрический ток своими ионами. Св-ва электролитов м. проявлять р-ры или расплавы кислот, оснований, солей, а также твёрдые соли, щёлочи и некоторые оксиды. По степени диссоциации электролиты делятся на: сильные и слабые. К сильным относятся: кислоты (H2SO4; HNO3; HCl; HBr; HI), гидроксиды (из щелочных Ме и щелочно-земельных Ме), все соли. К слабым электролитам относятся: кислоты (органические, плавиковая), гидроксид амония.
7.9. Константа и степень диссоциации.
Степенью диссоциации наз-ся отношение числа молекул распавшихся на ионы к общему числу молекул растворенного в-ва.
СН3ООН=СН3СОО-+Н+
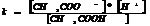
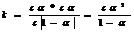
H3PO4=H++H2PO4- k1
H2PO4-= H++HPO4-2 k2
HPO4-2= H++PO4-3 k3
k1>>k2>>k3
7.10. Активность ионов, коэф. активности, ионная сила р-ров.
Для оценки состояния ионов в растворе пользуются величиной, называемой активностью. Под активностью иона понимают ту эффективную, условную концентрацию его, соответственно γ он действует при хим. р-циях. Активность иона = его концентрации, умноженной на коэф. активности. Поскольку обычно для хар-ки р-ров электролитов исп-ся молярная доля (хВ), моляльная (сm) и молярная (сВ) концентрации, то и исп-ются 3 различных вида коэф. активности:
1. αВ=f*хВ, 2. αВ=γ*сm ,
3. αВ=y*cВ
где f, γ, y – рациональный, моляльный и молярный коэф. активности. Коэф. активности различных ионов различны. Они изменяются в зависимости от условий. В концентрированных растворах коэф. активности меньше 1, а с разбавлением р-ра он приближается к 1. Значение f, меньшее 1, указывает на взаимодействие м/у ионами, приводящее к их взаимному связыванию. В разбавленных р-рах природа ионов мало влияет на значение их коэф. активности. Приближённо м. считать, что коэф. активности данного иона зависит только от его заряда и от ионной силы р-ра I, под γ понимают полусумму произведений концентраций всех находящихся в р-ре ионов на квадрат их заряда:
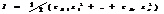
7.11. Смещение равновесия диссоциации.
Равновесие в р-рах электролитов, как и всякое хим-ое равновесие, сохр-ся неизменным, пока определяющие его условия не меняются. Равновесие нарушается при изменеии концентрации 1 из участвующих ионов: при ее увеличении происходит процесс, в ходе γ эти ионы связываются. Следовательно, введение в р-р слабого электролита одноименных ионов уменьшает степень диссоциации этого электролита, и наоборот. Обязательным условием протекания р-ции я-я удаление из р-ра тех или иных ионов, например, вследствии образования слабо диссациирующих в-в или в-в, выделяющихся из р-ров в виде осадка или газа. Т.е. р-ции в р-рах электролитов всегда идут в сторону образования наименее диссоциированных или наименее растворимых в-в.
Ионное произведение воды.
Для воды и разбавленных водных р-ров при неизменной температуре произведение концентраций Н и ОН ионов есть величина постоянная, она наз-ся ионным произведением воды.
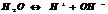
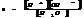
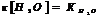
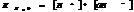
При 250С 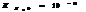
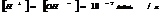
7.13. Водородный показатель.
Кислотность или щёлочность разбавленных р-ров м. выразить так: вместо концетрации ионов Н+и ОН- (ионное произведение воды) указывают её десятичный логарифм, взятый с обатным знаком – это наз-ся водородным показтелем и обозначается рН.
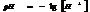
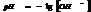
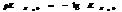
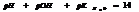
нейт. среда рН=рОН=7
кисл. pH<7
щёлоч. pH>7
7.14. Произведение растворимости.
В насыщенном р-ре электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Эта величина кол-но характеризует способность электролита растворяться, её наз-ют произведением растворимости. 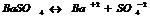
осадок р-р.
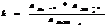
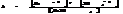
Произведение растворимости:
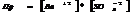
7.15. Условие образования и растворения осадка.
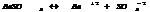
осадок р-р.
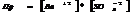
Если 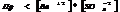 , то образуется осадок, если
, то образуется осадок, если 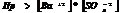 , то происходит растворение.
, то происходит растворение.
