Витамин А (ретинол, антиксерофтальмический)
Суточная потребность
1,0-2.5 мг или 5000ЕД
Источникирыбий жир (19 мг%), печень морских рыб (4-14 мг%), крупного рогатого скота, свиньи, жирномолочные продукты (сливочное масло, сливки, сметана), желток яиц (0,6 мг%);каротиноиды имеются в моркови, красном перце, томатах (красные овощи), пальмовое масло (80 мг%), облепиховое масло (40 мг%),
Метаболизм
Всасывается только 1/6 часть потребленныхкаротиноидов. После всасывания каротиноиды превращаются в ретинол, при этом из -каротина образуется 2 молекулы витамина А, из других только по одной молекуле.
Строение
Биохимические функции
1. Повышает считывание генов рецепторов к факторам роста. Благодаря этому:
регулирует нормальный рост и дифференцировку клеток эмбриона и молодого организма;
регулирует деление и дифференцировку быстро делящихся тканей – хряща, костной ткани, сперматогенного эпителия, плаценты, эпителия кожи, слизистых, иммунной системы.
2. Участвует в фотохимическом акте зрения. Родопсин находится преимущественно в палочках, отвечающих за черно-белое зрение.
3. Антиоксидантная функция, особенно это относится к каротиноидам.
Гиповитаминоз
1. При сильном гиповитаминозе и авитаминозе происходит нарушение темновой адаптации – куриная слепота;
2. Задержка роста, похудание, истощение;
3. Специфические поражения глаз, слизистых оболочек, кожи.
глаза — ороговение эпителия слезного канала (ксерофальмия) приводит к его закупорке. Это порождает во-первых, сухость роговой оболочки глаза, т.к. нет слезы, во-вторых, влечет за собой воспаление роговой оболочки из-за отсутствия лизоцима (антибактериального фермента слезы). Оба фактора приводят к кератомаляции — отек, изъязвление, размягчение роговой оболочки;
слизистые оболочки—из-за снижения синтеза гликопротеинов и нарушения барьерной функции слизистых оболочек происходит поражение эпителия желудочно-кишечного тракта, дыхательных путей и мочеполовой системы (также нарушение сперматогенеза);
кожа — гиперкератоз (пролиферация и патологическое ороговение кожи, сухость и шелушение – т.н. «жабья кожа») приводит к вторичным гнойным процессам
4. Стерильность – желтое тело беременности накапливает каротиноиды
Лекарственные формы
Ретинолацетат, ретинолпальмитат (функциональная ОН-группа защищена жирными кислотами)
3. В сыворотке крови обнаружены белки, так как реакция положительна. Так как реакция Фоля отрицательна, значит в крови отсутствуют аминокислоты цистин и цистеин (серосодержащие). Ксантопротеиновая реакция отрицательна, следовательно, в крови отсутствуют аминокислоты, сожержащие ароматический радикал (тирозин, триптофан, фенилаланин).
Биуретовая реакция проводится в пробирке с исследуемым образцом (кровь) при добавлении раствора щелочи и меди сульфата и нагревании раствора. Реакция считается положительной при появлении фиолетового окрашивания.
Реакция Фоля: к раствору исследуемого образца прибавляют 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II).
Ксантопротеиновая реакция: В пробирку к исследуемому образцу добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора.
Билет №9
Уровни организации белков
Первичная структура
Это последовательность аминокислот в полипептидной цепи. Учитывая, что в синтезе белков принимает участие 20 аминокислот можно сказать о невообразимом количестве возможных белков.
Первичная структура белков задается последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка.
Если изменение последовательности аминокислот носит не летальный характер, а приспособительный или хотя бы нейтральный, то такой белок может передаться по наследству и остаться в популяции. В результате возникают новые белки и новые качества организма. Такое явление называется полиморфизм.
Последовательность и соотношение аминокислот в первичной структуре определяет формирование вторичной, третичной и четвертичной структур.
Вторичная структура
Это способ укладки полипептидной цепи в упорядоченную структуру, при которой взаимодействуют близко расположенные вдоль цепи аминокислоты. Формирование вторичной структуры вызвано стремлением пептида принять конформацию с наибольшим количеством водородных связей между группами.
Можно выделять два возможных варианта вторичной структуры: a-спираль и b-складчатый слой.
А-спираль
Правозакрученная спираль, образуется при помощи водородных связей между пептидными группами каждого 1 и 4 аминокислотных остатков.
Высота витка составляет 0,54 нм и соответствует 3,6 аминокислотных остатков, 5 витков соответствуют 18 аминокислотам и занимают 2,7 нм.
В-структура
В этом способе укладки белка полипептидная цепь вытянута, ее пептидная группа взаимодействует с отдаленными участками той же цепи, или же с другими цепями (числом от 2 до 5). Ориентация цепей может быть параллельна или антипараллельна. В одном белке, как правило, присутствует и а-спираль и в-структура (складчатый слой). В глобулярных белках преобладает а-спираль, в фибриллярных – в-структура.
Третичная структура
Это взаимная укладка областей и отдельных аминокислотных остатков полипептидной цепи. Четкой границы между вторичной и третичной структурами провести нельзя, однако под третичной структурой понимают стерические взаимосвязи между аминокислотами, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактное формирование цепи.
Наряду с а-спиралью и в-структурой в третичной структуре обнаруживается так называемая неупорядоченная конформация, которая может занимать значительную часть молекулы. В разных белках наблюдается разное соотношение типов структур.
В формировании третичной структуры принимают участие различные связи:водородные и ван-дер- ваальсовые, дисульфидные, псевдопептиды, ионные
Четвертичная структура
Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными) связями, то говорят, что они обладают четвертичной структурой. Такие агрегаты стабилизируются водородными связями и электростатическими взаимодействиями между остатками аминокислот, находящихся на поверхности глобулы.
Подобные белки называются олигомерами, а их индивидуальные цепи – протомерами (мономерами, субъединицами). Если белки содержат 2 протомера, то они называются димерами, если 4, то тетрамерами и т.д.
2. Витамин В2 (рибофлавин, витамин роста)
Суточная потребность 2,0-2,5 мг
Источникимясные продукты, печень, почки, молочные продукты, дрожжи;образуется кишечными бактериями.
Строение
| Строение коферментной формы | ||
Метаболизм
В кишечнике рибофлавин освобождается из пищевых ФМН и ФАД, диффундирует в кровь. В слизистой кишечника и других тканях вновь образуется ФМН и ФАД.
Биохимические функции
Кофермент оксидоредуктаз – обеспечивает перенос 2 атомов водорода в окислительно-восстановительных реакциях:
Гиповитаминоз
Поражение слизистых – сухость рта губ, роговицы, трещины в уголках рта и губах, шелушение кожи из-за снижения роста эпителия.
Сухость конъюктивы, ее воспаление и васкуляризация роговицы, что компенсаторно увеличивает кровоток и снабжение кислородом (компенсаторная реакция для улучшения энергетики)
Антивитамины В2
1. Акрихин (атебрин) – ингибирует функцию В2 у простейших. Используется при лечении малярии, кожного лейшманиоза, трихомониаза, гельминтозов (лямблиоз, тениидоз).
2. Мегафен – тормозит образование ФАД в нервной ткани, используется как седативное средство.
3. Токсофлавин – ингибитор флавиновыхдегидрогеназ.
Лекарственные формы
Свободный рибофлавин, ФМН и ФАД (коферментные формы).
3.
Билет №10
III класс. Гидролазы.
Гидролазы — ферменты, осуществляющие разрыв внутримолекулярных связей в субстрате (за исключением С-С связей) путем присоединения элементов Н2О. подразделяется на 13 подклассов. Ввиду сложности многих субстратов у ряда ферментов сохранены тривиальные названия: пепсин, трипсин. Коферменты отсутствуют.
Гидролазы сосредоточены в основном в желудочно-кишечном тракте и в лизосомах клеток тканей. Осуществляют распад макромолекул, образуя легко адсорбируемые мономеры.
Основные подклассы: группы ферментов, действующих на сложные эфиры, на простые эфиры, на пептиды, на углерод-углеродные связи.
Название образуется:
гидролизуемый субстрат + отделяемая группа + гидролаза
Пример: Ацетилхолин:ацетил-гидролаза
Класс: 3. Гидролазы
Подкласс: 3.1. Действующие на сложные эфиры
Подподкласс: 3.1.1. Гидролазы карбоновые кислоты
Классификационный номер: КФ 3.1.1.7.
Протеолитические ферменты (синоним: протеазы) — белки, пептид-гидролазы, ферменты класса гидролаз, расщепляющие пептидные связи между аминокислотами в белках и пептидах.
Протеолетические ферменты (протеазы) является активным компонентам во многих ферментных препаратах, применяемых для коррекции секреторной дисфункции желудка и нарушений процесса пищеварения в тонкой кишке.
2. Понятием витаминыв настоящее время объединяется группа низкомолекулярных веществ разнообразной природы, которые необходимы для биохимических реакций, обеспечивающих рост, выживание и размножение организма. Витамины обычно выступают в роли коферментов – таких молекул, которые непосредственно участвуют в работе ферментов. Витамины называют <пламень жизни>, так как жизнь без витаминов невозможна.
Некоторые витамины поступают в организм в виде провитаминов. В организме провитамины превращаются в активные формы, например.
- каротиноиды превращаются в витамин А;
- пищевой эргостерин или метаболит 7‑дегидрохолестерин под действием ультрафиолетовых лучей превращаются соответственно в эргокальциферол (D2) и холекальциферол (витамин D3).
Нехватка витаминов ведет к развитию патологических процессов в виде специфических гиповитаминозов или авитаминозов. Скрытые формы витаминной недостаточности не имеют каких-либо внешних проявлений и симптомов, но оказывают отрицательное влияние на работоспособность, общий тонус организма и его устойчивость к разным неблагоприятным факторам.
Причины нехватки витаминов могут быть:
а. Экзогенные:
нерациональное питание, т.е. недостаточное потребление с пищей;
гельминтозы, лямблиозы, дизентерия
дисбактериоз кишечника
б. Эндогенные:
нарушение всасывания (энтероколиты, гастроэнтериты различного происхождения);
заболевания печени и желчного пузыря (для жирорастворимых витаминов);
повышенная потребность (беременность, лактация, физические нагрузки);
генетические дефекты кофермент-образующих ферментов.
Гипервитаминоз — острое расстройство в результате интоксикации сверхвысокой дозой одного или нескольких витаминов (содержащихся в пище или витаминсодержащих лекарствах)
Чаще всего гипервитаминозы вызываются приёмом резко повышенных доз витаминовА и D.
Лечение производится отменой приёма витаминов, обильным питьём (форсированный диурез), антидотами.
3.Белки в растворе и соответственно в организме сохраняются в нативном состоянии за счет факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная оболочка вокруг нее. Удаление этих факторов приводит к склеиванию молекул белков и выпадению их в осадок. Осаждение белков может быть обратимым и необратимым в зависимости от реактивов и условий реакции. В клинической лабораторной практике реакции осаждения используют для выделения альбуминовой и глобулиновой фракций белков плазмы крови, количественной характеристики их устойчивости в плазме, обнаружения белков в биологических жидкостях и освобождения от них с целью получения без белкового раствора.
Принцип пробы Вельтмана- при добавлении к сыворотке крови раствора хлористого кальция и действии нагревания происходит нарушение коллоидоустойчивости белков сыворотки.
Нормальные результаты пробы Вельтмана: 0,5 мл.
Принцип тимоловой пробы - при взаимодействии сыворотки с тимолово-вероналовым буфером появляется помутнение вследствие образования глобулино-тимоло-липидного комплекса.
Нормальные пределы тимоловой пробы: 0-4 Ед.
Билет №11
V класс. Изомеразы
Изомеразы — ферменты, катализирующие изомерные превращения в пределах одной молекулы. Выделяют 6 подклассов. Класс насчитывает более 80 ферментов. Изомеразы — сложные ферменты. К их коферментам относятся пиридоксалевые, дезоксиаденозинкобаламин, пептидные (глутатион), фосфаты моносахаридов (глюкозо-1,6-дифосфат) и др.
В подласс выделяются рацемазы и эпимеразы, цис-транс-изомеразы, внутримолекулярные оксидоредуктазы.
Название образуется:
субстрат + реакция
Пример: Глицерол-3-фосфат-изомераза
Класс: 5. Изомеразы
Подкласс: 5.4. Внутримолекулярные трансферазы
Подподкласс: 5.4.2. Фосфотрансферазы
Класификационный номер: КФ 5.4.2.1.
Пиридоксальфосфат 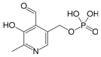
- принимает участие в образовании эритроцитов;
- участвует в процессах усвоения нервными клетками глюкозы;
- необходим для белкового обмена и трансаминированияаминокислот;
- принимает участие в обмене жиров;
- оказывает гипохолестеринемический эффект;
- оказывает липотропный эффект, достаточное количество пиридоксина необходимо для нормального функционирования печени.
2. Витамин В3 (ниацин, РР, антипеллагрический)
Суточная потребность 15-25 мг
ИсточникиМясные и растительные продукты, но в молоке и яйцах мало.синтезируется в организме из триптофана, примерно 1 молекула витамина на 60 молекул аминокислоты (примерно 60-80 мг).
| Строение |
| Существует в виде никотиновой кислоты или никотинамида Строение коферментной формы Существует в виде НАД и фосфорилированной формы НАДФ |
Биохимические функции
Перенос гидрид-ионов Н– (атом водорода и электрон) в окислительно-восстановительных реакциях
1. Кофермент большинства дегидрогеназ синтеза и окисления жиров и углеводов
НАДН является регулятором окислительно-восстановительных реакций.
НАДФН является необходимым компонентом антиоксидантной системы.
НАДФН необходим для синтеза тетрагидрофолиевой кислоты из фолиевой
Гиповитаминоз
Пеллагра (итал.: pelleagra – шершавая кожа):
Проявляется как синдром трех Д: деменция (нервные и психические расстройства, слабоумие), дерматиты (фотодерматиты), диарея (слабость, расстройство пищеварения, потеря аппетита). При отсутствии лечения заболевание кончается летально. У детей наблюдается замедление роста, похудание, анемия.
Антивитамины
Фтивазид,тубазид, ниазид используемые для лечения туберкулеза
Лекарственные формы:
Никотинамид и никотиновая кислота.
3.Обратимое осаждение.
Под действием факторов осаждения белки выпадают в осадок, но после прекращения действия (удаления) этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства. Одним из видов обратимого осаждения белков является высаливание.
Высаливание. Насыщенным раствором сульфата аммония осаждается альбуминовая фракция белков, полунасыщенным раствором - глобулиновая фракция.
Сущность реакции заключается в дегидратации молекул белка.
Ход определения. В пробирку наливают 30 капель неразведенного яичного белка и добавляют равное количество насыщенного раствора сульфата аммония. Содержимое пробирки перемешивают. Получают полунасыщенный раствор сульфата аммония, при этом глобулиновая фракция осаждается, а альбуминовая остается в растворе. Последнюю отфильтровывают, затем смешивают с порошком сульфата аммония до тех пор пока не прекратится растворение соли, при этом выпадает осадок - глобулины.
Необратимое осаждение белков.
Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов.
Осаждение при кипячении.
Белки являются термолабильными соединениями и при нагревании свыше 50-60 градусов С денатурируются. Сущность тепловой денатурации заключается в разрушении гидратной оболочки, разрыве стабилизирующих белковую глобулу связей и развертывании белковой молекулы. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке (когда заряд молекулы равен нулю), поскольку частицы белка при этом наименее устойчивы. Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами - в слабощелочной. В сильнокислых или сильнощелочных растворах денатурированный при нагревании белок в осадок не выпадает, т.к. его частицы перезаряжаются и несут в первом случае положительный, а во втором - отрицательный заряд, что повышает их устойчивость в растворе.
Осаждение концентрированными минеральными кислотами.
Концентрированные кислоты (серная, хлористоводородная, азотная и др.) вызывают денатурацию белка за счет удаления факторов устойчивости белка в растворе (заряда и гидратной оболочки). Однако при избытке хлористоводородной и серной кислоты выпавший осадок денатурированного белка снова растворяется. По-видимому, это происходит в результате перезарядки молекул белка и частичного их гидролиза. При добавлении избытка азотной кислоты растворения осадка не происходит. Вот почему для определения малых количеств белка в моче при клинических исследованиях применяется азотная кислота.
Осаждение органическими кислотами.
Трихлоруксусная кислота осаждает только белки, а сульфосалициловая осаждает не только белки, но и высокомолекулярные пептиды. Сульфосалициловой кислотой пользуются при определении белка в моче.
Ход определения. В две пробирки вносят по 5 капель раствора белка. В одну из них прибавляют 2 капли сульфосалициловой кислоты, а в другую - 5 капель трихлоруксусной кислоты. В пробирках выпадает осадок белка.
Осаждение белка солями тяжелых металлов.
Белки при взаимодействии с солями свинца, меди, ртути, серебра и других тяжелых металлов денатурируются и выпадают в осадок. Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле.
Ход определения. В три пробирки вносят по 5 капель белка. В первую добавляют 1 каплю ацетата свинца, в третью - 1 каплю нитрата серебра. Во всех пробирках выпадает осадок. Затем в первую пробирку добавляют 10 капель нитрата серебра - растворения осадка нет.
Билет №12
