Массовая доля растворённого вещества
Массовая доля растворённого вещества (ωр.в., %) показывает сколько граммов растворённого вещества содержится в 100 граммах раствора.




ω % (р.в.) = m(р.в.) *100 % ,
m (р – ра) (1)
где m (р – ра) = m (р.в.) + m (р – ля)
 |
Между массой раствора, объёмом и плотностью существует соотношение, т.к.
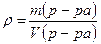 (г/см3) или (г/мл), то т(р – ра) = ρ*V,
(г/см3) или (г/мл), то т(р – ра) = ρ*V,
|
А. Приготовление растворов с заданной массовой долей растворённого вещества ω3 смешением двух растворов: с большей ω1 и меньшей ω2 массовой долей того же самого вещества.
При этом требуется найти массу более концентрированного (m1) и менее концентрированного (m2) растворов. Используется «правило креста», суть которого отражает схема:
 ω1 m1 = ω3 – ω2
ω1 m1 = ω3 – ω2
ω3
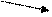 ω2 m2 = ω1 – ω3
ω2 m2 = ω1 – ω3
Пусть, например, требуется приготовить раствор с массовой долей 10% массой 70 г из 5 % и 40 %.
Подставим эти числа в приведённую ниже схему. Получаем:
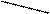
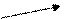 40 m1 = 10 – 5 = 5
40 m1 = 10 – 5 = 5
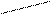
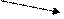 10
10
5 m2 = 40 – 10 = 30
Откуда 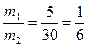
Например, взяв 10 г раствора ω = 40% и 60 г раствора с ω = 5%, получим 70 г раствора с ω = 10%.
Б. Приготовление растворов путём разбавления концентрированных растворов.
Так как при разбавлении растворов масса (р.в.) неизменна (m*ω) = const, то существует обратно пропорциональная зависимость между отношением масс растворов и их массовыми долями
|
Молярная концентрация раствора
Молярная концентрация раствора (См, моль/л.) показывает число моль растворённого вещества, содержащегося в 1 л раствора.
СМ = n моль, если V в мл, то СМ = n*1000 ,
V л. V мл
где n = m (р.в.),
М (р.в.)
|
(2)
Молярным называют раствор, в 1 л которого содержится 1 моль растворённого вещества.
Эквивалентом (Э) называется такое количество элемента или вещества (по массе), которое без остатка взаимодействует с 1 моль атомов или ионов водорода, с 1 моль электронов в окислительно-восстановительной реакции или 1 моль любого вещества в любой химической реакции.
Эквивалент – величина переменная для одного и того же вещества и рассчитывается по уравнению реакции или по формуле:
|
f (кислоты) = 1 ,
число ионов (Н+), участвующих в х.р.
f (основания) = 1 ,
число ионов (ОН‾ ), участвующих в х.р.
f (кислоты) = 1 ,
число ионов (Меn+) * n
где n- заряд иона металла.
Закон эквивалентов
|
Вид: , где Сн1 и Сн2 – молярная концентрация эквивалентов анализируемого и стандартного (концентрация которого точно известна) растворов, а V1 и V2 – соответственно их объёмы.
Перевод одного способа выражения концентрации
Раствора в другой
Нужно помнить, что масса растворённого вещества – неизменная и общая для формул любого способа выражения концентрации величина, следовательно, при помощи её и производят перевод.
а) перевод массовой доли растворённого вещества в молярную концентрацию.
|
б) перевод массовой доли растворённого вещества в молярную концентрацию эквивалента.
|
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ ПО ТЕМЕ: «СПОСОБЫ ВЫРАЖЕНИЙ
КОНЦЕНТРАЦИЙ РАСТВОРОВ»
Задача № 1
К 120 мл. раствора с массовой долей NaCl 16 % и плотностью 1,16 г/см3 прилили воду объёмом 80 мл. Рассчитайте ω%, См, Сн полученного раствора.
 Дано: Решение:
Дано: Решение:
Vр-ра = 120 мл 1. Находим массу 16 % раствора, зная, что
 ρ1(р-ра) = 1,16 г/см3 ρ = m , m = ρ *V,
ρ1(р-ра) = 1,16 г/см3 ρ = m , m = ρ *V,
ω1 %(NaCl) = 16 % V
V(H2O) = 80 мл m (р-ра) = 120 *1,16 = 139,2 г
ρ2 = 1,071 г/см32. Из формулы: ω % (р.в.) = m (р.в.) *100 % ,
М(NaCl) = 58,5 г/моль m(р – ра)
определяем m (р.в.) в 16 % растворе: 
ω2 %= ? m (р.в.) = ω *m (р-ра) ,
Сн = ?
См = ? m (р.в.) = 0,16 *139,2 = 22,27 г
3. После прибавления воды масса раствора изменилась, т.к. ρ(Н2О) = 1 г/см3, то m (р-ра) = 139,2 + 80 = 219,2 г.
4. Находим массовую долю растворённого вещества в новом растворе:
ω2% = 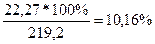
5. Определяем См, зная формулу перерасчета:
См = 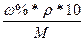
См = 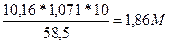
6. Определяем Сн, но т.к. f(NaCl) = 1 и Э = М (NaCl), то
Сн = См = 1,86 н
Ответ: ω2% = 10,16%, См = 1,86 М, Сн = 1,86 н
Задача №2
На нейтрализацию 20 мл 0,2 н раствора соляной кислоты израсходовано 15 мл гидроксида калия. Рассчитайте Сн (КОН).
 Дано: Решение:
Дано: Решение:
V(HCl) = 20 мл 1. Зная закон эквивалентов,
C(HCl) = 0,2 н Сн (к-ты) *V(к-ты) = Сн (щ) *V(щ),
 V(KOH) = 15 мл находим С(КОН)
V(KOH) = 15 мл находим С(КОН)
Сн (КОН) = 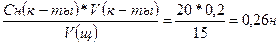
Ответ: Сн (КОН) = 0,26 н
