Опыт 1. Получение гидрозоля серы методом замены растворителя
К 5-10 мл дистиллированной воды прилить 5-10 капель насыщенного раствора серы в абсолютном спирте. Наблюдать образование молочно-белого опалесцирующего золя.
Опыт 2. Получение золя гидроксида железа (III)
К 85 мл дистиллированной воды, нагретой до кипения, по каплям прилить 10 мл 2%-го раствора хлорида железа (III) FeCl3. Наблюдать образование золя гидроксида железа, окрашенного в интенсивный красно-коричневый цвет. Написать строение мицеллы золя гидроксида железа с учетом того, что в роли стабилизатора выступает дигидроксохлорид железа Fe(OH)2Cl, который является промежуточным продуктом при образовании гидроксида железа в ходе гидролиза. Дигидроксохлорид железа распадается по реакции:
Fe(OH)2Cl = FeO+ + Cl– + Н2O.
При составлении формулы потенциалопределяющие ионы выбрать, используя данные опыта 5, и подтвердить выбор на основании правила Пескова—Фаянса.
Раствор сохранить для опытов 5 и 6.
Опыт 3. Получение золя сульфида меди
К 5 мл сероводородной воды добавить 0,5 мл очень разбавленного раствора сульфата меди CuSO4. Наблюдать образование золя сульфида меди (золь заряжен отрицательно), окрашенного в коричневый цвет. Написать строение мицеллы золя.
Раствор сохранить для опыта 6.
Опыт 4. Получение геля кремниевой кислоты
К 5 мл концентрированного раствора силиката натрия прибавить 1-1,5 мл разбавленной соляной кислоты HCl. Наблюдать выделение геля кремниевой кислоты. Написать строение мицеллы золя, учитывая, что в избытке взят силикат натрия.
Опыт 5. Коагуляция электролитами
золя гидроксида железа (III)
Полученный в опыте № 2 коллоидный раствор разлить в четыре пробирки. В первую добавить несколько капель раствора хлорида натрия NaCl, во вторую — раствора сульфата натрия Na2SO4, в третью — фосфата натрия Na3PO4. Раствор в четвертой пробирке является раствором сравнения. Через несколько минут наблюдать явление коагуляции. Какой из электролитов приводит к более быстрой коагуляции и почему? Полученные результаты занести в таблицу по следующей форме:
| № пробирки | Формула электролита | Скорость коагуляции (качественная оценка) |
Сопоставить данные с правилами коагуляции Шульце—Гарди и сделать вывод о заряде гранул золя.
Опыт 6. Взаимная коагуляция золей
В пробирку налить равные объемы коллоидных растворов гидроксида железа (III) из опыта 2 и сульфида меди из опыта 3. Наблюдать взаимную коагуляцию золей. Объяснить наблюдаемый эффект, используя данные о формулах мицелл сливаемых золей.
КОНТРОЛЬНОЕ ЗАДАНИЕ
1. При смешении растворов веществ А и B (вещество В берется в избытке) образуется золь вещества С. Написать формулу мицеллы золя, указать знак заряда его коллоидных частиц. Указать, какой из коагуляторов будет наиболее эффективным.
| Вариант | А (разб) | В | С | Коагулятор |
| 1. | NaI MgCl2 NH4CNS BeCl2 BaCl2 (NH4)2S AlCl3 CrCl3 MnCl2 CoCl2 NiCl2 Pb(NO3)2 Na2SiO3 K2CrO4 SnCl2 | AgNO3 NaOH AgNO3 NH4OH CaSO4 AgNO3 NaOH NH4OH (NH4)2S H2S (NH4)2S KI HCl AgNO3 (NH4)2S | AgI Mg(OH)2 AgCNS Be(OH)2 BaSO4 Ag2S Al(OH)3 Cr(OH)3 MnS CoS NiS PbI2 H2SiO3 Ag2CrO4 SnS | NaF, Ca(NO3)2, K2SO4 KCl, Zn(NO3)2, AlCl3 KNO3, CH3COONa, Na2SO4 Na2SO4, KNO3, Zn(CH3COO)2 NH4Cl, AlCl3, Zn(CH3COO)2 Ba(NO3)2, CH3COONa, Na2SO4 Na2SO4, KNO3, CaCl2 Na2SO4, KCl, BaCl2 BaBr2, K2SO4, NaCl NaCl, K2SO4, CaCl2 NH4Cl, Na2SO4, SrCl2 Ca(OH)2, NH4NO3, AlBr3 Na2SO4, Al(NO3)3, NH4Cl Zn(NO3)2, NH4NO3, CH3COONa Na2SO4, KCl, Ca(CH3COO)2 |
2. Для коагуляции 100 мл золя гидроксида железа потребовалось добавить следующие количества каждого из электролитов: 10,5 мл 1 н. раствора KCl; 62,5 мл 0,01 н. раствора Na2SO4 и 37 мл 0,001 н. раствора Na3PO4. Определить знак заряда золя и пороги коагуляции. Записать формулу мицеллы золя.
3. Даны пороги коагуляции для следующих электролитов (ммоль экв/л): KNO3 — 50; MgCl2 — 0,717; Na3PO4 — 43; Na2SO4 — 49; MgSO4 — 0,810; AlCl3 — 0,099. Каков заряд частиц золя?
4. Порог коагуляции золя Al(OH)3 составляет 0,63 ммоль/л. Какой объём 0,01 н. раствора K2Cr2O7 надо добавить к 100 мл золя, чтобы вызвать его коагуляцию?
5. Золь иодида серебра получен путём смешивания равных объёмов 0,1 н. раствора иодида калия и 0,008 н. раствора нитрата серебра. Какой из электролитов: K3[Fe(CN)6] или MgSO4 будет иметь больший порог коагуляции для данного золя и почему?
6. Какой объём 0,001М FeCl3 надо прибавить к 0,3 л 0,02 н. раствора AgNO3, чтобы частицы хлорида серебра двигались в электрическом поле к аноду? Написать формулу мицеллы золя.
7. Золь гидроксида кадмия получен путём сливания растворов хлорида кадмия и гидроксида натрия (один из растворов берётся в избытке). Каков знак заряда коллоидных частиц, если пороги коагуляции 0,1 н. растворами электролитов оказались равными
(ммоль экв/л): K2SO4 — 10, Mg(NO3)2 — 50, K3PO4 — 0,1. Написать формулу мицеллы золя.
8. Золь сульфата бария получен путём сливания равных объёмов 0,01 н. раствора нитрата бария и 0,008 н. раствора сульфата натрия. Какой из двух электролитов: Mg3(PO4)2 или FeCl3 будет иметь больший порог коагуляции для данного золя?
9. Золь иодида серебра получен при добавлении к 20 мл 0,01 н. раствора KI к 15 мл 0,15%-го раствора AgNO3 (плотность d = 1 г/см3). Каков заряд и строение мицеллы?
10. Частицы сульфата бария, полученного смешением равных объёмов BaCl2 и H2SO4 перемещаются в электрическом поле к катоду. Одинаковы ли исходные концентрации растворов? Записать строение мицеллы золя.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Определение и особенности дисперсных систем, основные термины и понятия. Классификация дисперсных систем. Примеры систем с различным агрегатным состоянием.
2. Условия получения и существования коллоидных систем. Различные методы получения коллоидных систем.
3. Правило Пескова—Фаянса. Строение мицеллы золя; двойной электрический слой.
4. Явление коагуляции. Факторы коагуляции. Механизм действия коагуляции при нагревании и коагуляции электролитами.
5. Порог коагуляции.
6. Правила коагуляции Шульце—Гарди.
ЛАБОРАТОРНАЯ РАБОТА
«ЖЕСТКОСТЬ ВОДЫ. МЕТОДЫ УМЯГЧЕНИЯ И ОПРЕДЕЛЕНИЯ ЖЕСТКОСТИ»
Цель работы: экспериментальное определение карбонатной и общей жёсткости природной (водопроводной) воды.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Жёсткость воды
Компоненты и виды жёсткости
Природная пресная вода, которая широко используется в технологических процессах, в качестве питьевой воды и для хозяйственно-бытовых нужд, находится в непрерывном взаимодействии с окружающей средой. Она реагирует с компонентами атмосферы, почвы, растений, с минералами и различными породами, растворяя различные органические и неорганические соединения. Состав природных вод является результатом этих взаимодействий.
В наибольшем количестве в природной воде содержатся:
— катионы: ионы металлов натрия Na+, калия K+, кальция Ca2+ и магния Mg2+;
— анионы: карбонат-ионы CO32–, гидрокарбонат-ионы HCO3–, сульфат-ионы SO42–, хлорид-ионы Cl–;
— растворенные газы атмосферного воздуха — углекислый газ CO2 и кислород O2.
Практически все соли натрия и калия хорошо растворимы в воде, в т.ч. и те, которые натрий и калий образуют в сочетании с вышеперечисленными анионами. Изменение температуры воды, её солевого состава, величины pH, концентрации CO2 в атмосфере не приводят к каким-либо химическим процессам, связанным с присутствием ионов натрия и калия.
Напротив, многие соли кальция и магния ограниченно растворимы, и в результате изменения температуры, pH, давления CO2, внесения реагентов растворенные до того ионы кальция и магния могут образовывать осадок. Поэтому наличие ионов Ca2+ и Mg2+ является одной из важнейших характеристик природной воды. Присутствие указанных ионов в воде принято обозначать термином жёсткость воды. Соответственно, вода, которая не содержит соли кальция и магния или содержит в очень незначительных количествах, характеризуется как мягкая вода.
Ионы Ca2+ и Mg2+ появляются в природных водах в результате взаимодействия их с известняками (CaCO3), доломитами (CaCO3∙MgCO3), гипсом CaSO4. В отличие от случая взаимодействия воды с гипсом, переход кальция и магния в раствор из карбонатных пород (известняков и доломитов) является результатом не простого растворения солей, а химического процесса при участии углекислого газа, которым насыщена вода водоемов (CO2 из атмосферы) и почва (CO2 появляется в ходе разложения органических компонентов). При этом малорастворимые карбонаты переходят в растворимые гидрокарбонаты по реакциям:
CaCO3 + CO2 + H2O = Ca(HCO3)2 ;
MgCO3 + CO2 + H2O = Mg(HCO3)2 .
Суммарное содержание ионов кальция и магния определяет общую жёсткость воды. Поскольку каждый из этих ионов входит в состав разных солей, то в суммарной величине общей жёсткости различают различные виды жёсткости. Деление можно провести по трем критериям:
1. По катиону
— кальциевая жёсткость, связанная с присутствием солей Ca;
— магниевая жёсткость, связанная с присутствием солей Mg.
2. По анионам, образующим соли, придающие воде жёсткость:
— карбонатная жёсткость; обусловлена содержанием в воде карбонатов и гидрокарбонатов кальция и магния CaCO3, MgCO3, Ca(HCO3)2, Mg(HCO3)2;
— некарбонатная жёсткость; обусловлена содержанием в воде сульфатов и хлоридов кальция и магния CaSO4, MgSO4, CaCl, MgCl, т.е. растворимых солей сильных кислот.
3. По способу устранения жёсткости
— временная жёсткость — часть общей жёсткости, удаляемая кипячением воды при атмосферном давлении в течение 1 часа. Эта жёсткость может быть названа также гидрокарбонатной, поскольку обусловлена присутствием гидрокарбонатов кальция
и магния, которые при кипячении переходят в малорастворимые
карбонаты кальция и магния согласно уравнениям реакций:
Ca(HCO3)2 = CaCO3↓ + CO2↑ + H2O ;
Mg(HCO3)2 = MgCO3↓ + CO2↑ + H2O*.
При этом бо́льшая часть кальция и магния, содержавшаяся в гидрокарбонатах, уходит из раствора в виде осадков, но небольшая часть кальция и магния остается в растворе, так как осажденные карбонаты обладают некоторой растворимостью в воде (CaCO3 — 13 мг/л; MgCO3 — 110 мг/л), хотя и намного меньшей, чем гидрокарбонаты, из которых они образовались. Та часть карбонатной жёсткости, которая остается после кипячения воды и удаления тем самым гидрокарбонатной жёсткости, называется остаточной карбонатной жёсткостью.
— постоянная жёсткость — часть общей жёсткости, остающаяся после кипячения воды; эта жёсткость обусловлена присутствием карбонатов, сульфатов и хлоридов кальция и магния. Таким образом, постоянная жёсткость равна разности между общей и временной. С другой стороны, постоянная жёсткость равна сумме некарбонатной жёсткости и остаточной карбонатной.
Действие жёсткости
Соли, обусловливающие жёсткость воды, не являются вредными для здоровья. Жёсткость не ухудшает вкус питьевой воды, жесткая вода вкуснее мягкой. Однако жёсткость воды — нежелательное явление в ряде случаев:
1) При использовании жёсткой воды в отопительных системах, других системах приготовления и подачи горячей воды вследствие разложения гидрокарбонатов образуется накипь на внутренней поверхности кипятильного сосуда — от парового котла до чайника. Слой плотного осадка ухудшает условия передачи тепла через стенку котла, поскольку теплопроводность накипи в десятки раз меньше теплопроводности стали. Это приводит к перерасходу топлива. Кроме того, металл под накипью перегревается и размягчается, образуются вздутия и трещины, что может привести к разрыву котлов. Также внутреннее пространство труб, по которым подается горячая вода, постепенно забивается выпадающими в осадок солями.
2) Присутствие в воде солей MgSO4 и MgCl2 приводит к коррозии, поскольку гидроксид магния — весьма слабое основание и гидролиз солей сильных кислот магния приводит к образованию кислой среды.
Например, в ходе гидролиза образуются слабое основание и сильная кислота:
MgCl2+ H2O = Mg(OH)2 + 2HCl.
Затем ионы водорода взаимодействуют с железом:
Fe + 2HCl = FeCl2 + H2↑,
а в присутствии кислорода процесс окисления железа идет далее до образования трехвалентных ионов:
4FeCl2 + 4HCl + O2 = 4FeCl3 + 2H2O.
Последующая обменная реакция с накопившимся гидроксидом магния приводит к образованию ржавчины:
2FeCl3 + 3Mg(OH)2 = 2Fe(OH)3 + 3MgCl2.
3) При использовании в качестве моющего средства обычного мыла, которое представляет собой натриевые соли органических карбоновых кислот (так называемых жирных кислот — пальмитиновой СН3(СН2)14СООН и стеариновой СН3(СН2)16СООН) в жёсткой воде происходит выпадение осадка нерастворимых кальциевых солей этих кислот:
2СН3(СН2)14СООNa + Ca2+ = (СН3(СН2)14СОО)2Ca↓ + 2Na+.
Это приводит, во-первых, к непроизводительному расходу мыла, поскольку сначала оно частично расходуется на связывание солей жёсткости, а только затем может проявить свои моющие свойства (в мягкой воде, наоборот, возникает ощущение, что мыло с трудом смывается с рук). Во-вторых, если использовать мыло в жёсткой воде для стирки, волокна тканей адсорбируют кальциевые и магниевые мыла, что делает ткани хрупкими и ломкими, ведет к потере прочности и преждевременному износу.
4) В жёсткой воде овощи и мясо плохо развариваются, так
как соли кальция с белками пищевых продуктов образуют нерастворимые соединения, которые делают мякоть и кожицу плодов твердыми.
5) Чай в жёсткой воде плохо заваривается, поскольку наличие солей ухудшает условия экстракции (так называется переход веществ в воду из контактирующего с ней твердого вещества или несмешивающейся жидкости).
Единицы измерения жёсткости
Единой международной единицы измерения жёсткости не существует. В отечественной нормативной документации в качестве единицы измерения жёсткости используют ммоль экв/л (число миллимоль эквивалента иона кальция или магния, содержащихся в 1 литре воды)*. Молярная масса кальция составляет 40,08 г/моль. Молярная масса моля эквивалента кальция вдвое меньше (20,04 г/моль), так как заряд иона кальция равен +2 (о понятии химического эквивалента см. далее в разделе «1.4.1. Титриметрический метод анализа»). Соответственно, масса одного миллимоля эквивалента кальция равна 20,04 мг. Аналогичный расчет можно провести для двухвалентного иона магния (MMg2+ = 24,32 г/моль). Таким образом, величина жёсткости 1 ммоль экв/л соответствует содержанию 20,04 мг/л иона Ca2+ или 12,16 мг/л иона Mg2+.
Если содержание ионов кальция и магния было найдено другими методами, общую жёсткость воды Жобщ (ммоль экв/л) можно вычислить по формуле:
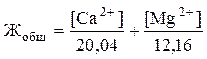 .
.
Различные страны используют свои условные единицы жёсткости. За рубежом в литературе и технической документации для характеристики содержания ионов кальция или магния используют так называемые «градусы жёсткости», пересчет которых в моль экв/л здесь мы не рассматриваем.
Жёсткость природной воды колеблется в широких пределах: она различна в разных водах, а в одном и том же водоисточнике её величина изменяется по временам года.
По величине общей жёсткости воду делят на 5 групп:
| Характеристика воды | Общая жёсткость, ммоль экв/л |
| Очень мягкая | до 1,5 |
| Мягкая | 1,5…3,0 |
| Средней жёсткости | 3,0…5,4 |
| Жесткая | 5, 4…10,7 |
| Очень жесткая | более 10,7 |
Наиболее мягкой является вода атмосферных осадков (0,07…0,10 ммоль экв/л). В качестве примера пресных вод с очень высокой жёсткостью приводят воды Донбасса, формирующиеся в окружении меловых и доломитных пород (18…20 ммоль экв/л). Еще выше жёсткость океанской воды — 130 ммоль экв/л. Жёсткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль экв/л.
Процесс, приводящий к снижению жёсткости, т.е. к уменьшению концентрации ионов Ca2+ и Mg2+ в воде, называется умягчением. Различают следующие методы умягчения:
— методы осаждения;
— методы ионного обмена.
