III. Гибридизация атомных орбиталей углерода.
Поскольку четыре электрона у атома углерода различны (2s- и 2p- электрона), то должны бы быть различны и связи, однако известно, что связи в молекуле метана равнозначны. Поэтому для объяснения пространственного строения органических молекул используют метод гибридизации.
1. Если в гибридизации участвуют всечетыре орбитали возбужденного атома углерода (одна s- и три p- орбитали), то образуются четыре новых равноценных sp3- гибридных орбитали, имеющие форму вытянутой гантели. Вследствие взаимного отталкивания sp3- гибридные орбитали направлены в пространстве к вершинам тетраэдра и углы между ними равны 109028' (наиболее выгодное расположение).
2. При sp2-гибридизации гибридизуются одна s- и две р-орбитали и образуются три гибридные орбитали, оси которых расположены в одной плоскости и направлены относительно друг друга под углом 120°.
3. При sp-гибридизации гибридизуются одна s- и одна р-орбитали и образуются две гибридные орбитали, оси которых расположены на одной прямой и направлены в разные стороны от ядра рассматриваемого атома углерода под углом 180°.
ТИПЫ ГИБРИДИЗАЦИИ в органических веществах.
| Тип гибридизации | Геометрическая форма | Угол между связями | Примеры | |
| sp | линейная | 180o | Атом С с тройной и одинарной связью ̶ С≡ | 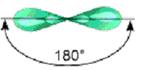 |
| sp2 | треугольная | 120o | Атом С с двойной и двумя одинарными связями ̶ С = | | 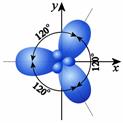 |
| sp3 | тетраэдрическая | 109028' | Атом С с четырьмя одинарными связями |  |
Строение молекулы метана: 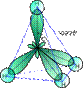 | Строение сигма (1) и пи (2) связей молекулы этилена. 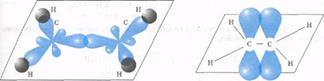 | Строение ацетилена 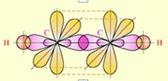 |
| sp3- гибридизация | sp2 - гибридизация | sp- гибридизация |
IV. Изомерия.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию
СТРУКТУРНАЯ ИЗОМЕРИЯ.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Веществ с молекулярной формулой С4Н10 существует два:
| н-бутан (с линейным скелетом): | и изо-бутан, или 2-метилпропан: |
| СН3 – СН2 – СН2 – СН3 | СН3 – СН – СН3 │ СН3 |

2. Изомерия положения обусловлена различным положением функциональной группы(группа атомов, определяющая наиболее характерные свойства веществ данного класса) илизаместителя при одинаковом углеродном скелете молекул. Так, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
СН3 – СН2 – СН2 – ОН и СН3 – СН – СН3
│
ОН
Изомерия непредельных соединений может быть вызвана различным положением кратной связи, как, например, в бутене-1 и бутене-2:
СН3-СН2-СН=СН2 и СН3-СН=СН-СН3
3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Пары межклассовых изомеров:
CnH2n - алкены и циклоалканы
CnH2n-2 - алкины и алкадиены (а также циклоалкены)
СnH2n+2O - спирты и простые эфиры.
CnH2nO - альдегиды и кетоны, а также: циклические спирты, циклические эфиры, непредельные спирты и эфиры.
CnH2nO2 - карбоновые кислоты и сложные эфиры.
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ.
