При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ.
Если все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не отличаются друг от друга. В других случаях встречаются небольшие отклонения от стандартных валентных углов. Например, в молекуле воды H2O кислород - sp3-гибридный, находится в центре неправильного тетраэдра, в вершины которого "смотрят" два атома водорода и две неподеленные пары электронов (рис. 3-10а). Форма молекулы угловая, если смотреть по центрам атомов. Валентный угол HОН составляет 105о, что довольно близко к теоретическому значению 109о.
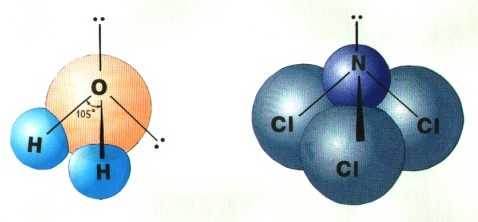
Рис. 3-10. sp3-гибридизация атомов кислорода и азота в молекулах а) H2O и б) NCl3.
Если бы не происходило гибридизации (“выравнивания” связей O-H), валентный угол HOH был бы равен 90°, потому что атомы водорода были бы присоединены к двум взаимно перпендикулярным р-орбиталям. В этом случае наш мир выглядел бы, вероятно, совершенно по-другому. Почему? На этот вопрос вы сможете ответить сами, когда прочтете о молекуле H2O в отдельной главе, посвященной воде и растворам.
7)Ионная связь — химическая связь, образующаяся между атомами с большой разностьюэлектроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.
Способность элементов образовывать простые ионы обусловлена электронной структурой их атомов. Эту способность можно оценить энергией ионизации и сродством атомов к электрону. Легче всего образуюткатионы щелочные и щелочно-земельные металлы.
Присоединение одного электрона к атомам кислорода, серы, углерода, некоторым другим элементам сопровождается выделением энергии. Присоединения последующих электронов с образованием свободных многозарядных простых анионов не бывает, поэтому соединения, состоящие из простых ионов, немногочисленны. Они легче всего образуются при взаимодействии щелочных и щелочно-земельных металлов с галогенами. Однако и в этом случае электронная плотность между ионами не равна нулю, поэтому можно говорить лишь о преимущественном проявлении ионной связи.
Свойства ионной связи
Так как ион может притягивать к себе ионы противоположного знака в любом направлении, ионная связь в отличие от ковалентной отличается ненаправленностью.
Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. Поэтому они могут притягивать и другие ионы противоположного знака, то есть ионная связь отличается ненасыщенностью.
8)Водородная связь
Водородная связь возникает между молекулами, в которых атом водорода связан с атомом элемента, обладающего высокой электроотрицательностью. Так, атом водорода, образующий в молекуле НХ прочную ковалентную связь с атомом X, может образовывать водородную связь с атомом X (или Y) другой молекулы. Водородную связь принято изображать пунктиром: X - Н …У. Обычно энергия водородной связи (8-80 кДж/моль) значительно уступает энергии химической связи, но намного больше энергии ван-дер-ваальсова взаимодействия (1-5 кДж/моль). Исключением является сильная водородная связь в ионе (FHF) (250 кДж/моль).
Возникновение водородной связи обусловлено двумя причинами:
1. Атом водорода, связанный полярной ковалентной связью с атомом X, фактически не имеет электронов и способен легко внедряться в электронные облака других частиц.
2. Обладая вакантной s-орбиталью, атом водорода может принимать неподеленную электронную пару атома Y, образуя с ним донорно-акцепторную связь.
Н Н
| |
Н – О · · · Н - О · · ·
· ·
· ·
Н - Н -
Определенный вклад в образование водородной связи вносит электростатическое взаимодействие между положительно поляризованным атомом водорода в молекуле Н—Xи отрицательно поляризованным атомом Y в другой молекуле. Чаще всего водородная связь образуется с участием атомов таких элементов, как кислород, фтор, азот. Наиболее типичный пример соединения с водородными связями — это вода. В жидком состоянии вода находится в виде ассоциатов (Н2О)n, а в кристаллах льда каждый атом кислорода образует по две водородные связи, что определяет его тетраэдрическое окружение.
Водородная связь существенно влияет на свойства веществ. Так, при ее наличии повышаются температура кипения, теплоты испарения и плавления, молекулы веществ в жидком состоянии становятся ассоциированными. Структура и свойства большинства органических веществ определяются образованием таких связей. Так, молекулы протеинов сохраняют свою спиральную форму из-за водородных связей. Они же удерживают вместедвойные спирали ДНК.
Мерой энергии межмолекулярного взаимодействия могут служить температура кипения и теплота испарения ΔНисп жидкости. Для некоторых жидкостей эти величины приведены в табл. 6.1.
Таблица 6.1. температура кипения и теплота испарения некоторых веществ
| Вещество | Ткип, К | ΔНисп. кДж/моль | Вещество | Ткип, К | ΔНисп. кДж/моль |
| Аr | 87,25 | 7,607 | С2Н6 | 184,52 | 14,63 |
| Кr | 119,75 | 9/025 | С3Н8 | 231,09 | 18,78 |
| Хе | 165,05 | 16,02 | С5Н12 | 309,22 | 25,79 |
| СН4 | 111,57 | 8,197 | Н2О | 373,15 | 40,66 |
Повышение Ткип и ΔНисп при переходе от Аг к Хе обусловлено увеличением поляризуемости, а с увеличением размеров частиц и, как следствие, к усилению дисперсионного взаимодействия. Увеличение Ткип и ΔНисппри переходе от СН4 к С5Н12 связано с тем, что с удлинением углеводородной цепи увеличивается число точек соприкосновения между молекулами и усилением межмолекулярного взаимодействия. Сравнительно высокие значения Ткип и ΔНиспводы — следствие ассоциации в результате возникновения водородных связей.
