Влияние внешних факторов на скорость
Химических реакций
Влияние концентрации. В тех случаях, когда для протекания реакции необходимо столкновение двух реагирующих частиц (молекул, атомов) зависимость скорости реакции от концентрации определяется законом действия масс (1867 г. К. Гульдберг, П. Вааге):
Скорость реакции, протекающей в гомогенной среде при постоянной температуре прямопропорциональна произведению молярных концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Например, для реакции типа А + B2 → AB2 закон действия масс выражается следующим образом:
v = [A] ∙ [B2] или v = k ∙CA∙CB  , где [A] или CA, [B2] или CB
, где [A] или CA, [B2] или CB  - молярные концентрации веществ А и В2; v - скорость прямой реакции; k - коэффициент пропорциональности, называемой константой скорости химической реакции (при CA = CB
- молярные концентрации веществ А и В2; v - скорость прямой реакции; k - коэффициент пропорциональности, называемой константой скорости химической реакции (при CA = CB  = 1 моль/л k численно равна v).
= 1 моль/л k численно равна v).
Константа скорости реакции k определяется природой реагирующих веществ и зависит от температуры, от присутствия катализатора, но не зависит от концентрации веществ.
Влияние природы реагирующих веществ. Влияние природы реагирующих веществ. Влияние природы реагирующих веществ можно проследить на примере следующих реакций протекающих при комнатной температуре:
2NO +O2 →2NO2
CH4 + 2O2 →CO2 + 2H2O
Первая реакция протекает умеренно, а вторая - практически не протекает. Различие в скоростях реакций объясняется
специфическими свойствами реагирующих веществ - NO и CH4.
Химические реакции, в которых происходит разрыв нескольких связей, и образуются новые связи при комнатной температуре, протекает медленно. Так в первой реакции разрывается одна связь и образуется две связи, а во второй - разрывается шесть связей и поэтому реакция идет очень медленно.
Необходимое условие протекания химических реакций - столкновение реагирующих частиц - атомов или молекул. В результате столкновений могут происходить перегруппировки атомов и возникновение новых химических связей, в результа-
те чего образуются новые вещества.
Чаще всего химическая связь образуется при столкновении двух частиц и гораздо реже - при столкновении трех частиц. Например, реакция типа А + 2B → AB2 может протекать по механизму тройных столкновений:
А + B + B → AB2
В этом случае, в соответствии с законом действующих масс можно записать:
v = k [A] ∙ [B] ∙ [B], т.е. v = [A] ∙ [B] 2 или v = ∙CA∙CB 2.
Одновременное столкновение более чем трех частиц крайне маловероятно. Поэтому реакции, в уравнениях которых входит большое число частиц, протекают в несколько простых стадий, каждая из которых осуществляется в результате столкновения двух, реже трех частиц. Закон действия масс справедлив для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Изучение этих стадий позволяет раскрыть механизм реакции.
Та стадия, скорость которой минимальна, определяет или лимитирует скорость реакции, в общем. Поэтому математическое выражение закона действия масс, записанное для самой медленной стадии процесса, приложимо одновременно и ко всей реакции в целом.
Например, окисление газообразного бромистого водорода протекает по уравнению:
HBr (г) + O2 (г) → 2 H2O (г) + 2Br2 (г)
Предполагается, что эта реакция состоит из следующих стадий:
HBr + O2 → HOOBr - медленная реакция.
HOOBr + HBr → 2HOBr - быстрая реакция
HOBr + HBr → H2O + Br2 - быстрая реакция
Самая замедленная стадия определяет скорость всей реакции окисления бромистого водорода
v = k ∙СHBr ∙ CO 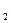 - первая стадия.
- первая стадия.
В химической кинетике взаимодействия классифицируют или по признаку молекулярности или по признаку порядка реакции.
Молекулярность реакции определяется числом молекул, одновременным взаимодействием которых осуществляется элементарный акт химического превращения.
Примером мономолекулярной реакции может служить термическая диссоциация газообразного йода:
I2 → 2I;
Бимолекулярной - разложение иодида водорода:
2HI → H2 + I2
Тримолекулярной - взаимодействие оксида азота с водородом:
2NO + H2 → N2O + H2O
Порядок реакции определяется зависимостью скорости реакции от концентрации каждого из исходных веществ при условии t = const.
Например, к реакциям первого порядка относится термическая диссоциация газообразного йода: I2→2I ( 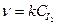 )
)
К реакциям второго порядка относятся реакции:
H2 + I2 → 2HI; 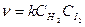
CH3Br + KOH → CH3OH + KBr; 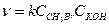
Влияние температуры.С повышением температуры увеличивается скорость движения молекул, что вызывает возрастание числа столкновений между ними и увеличение скорости химических реакций.
Количественно зависимость скорости гомогенных реакций от температуры выражается правилом Вант - Гоффа: при повышении температуры на каждые 100 скорость гомогенных химических реакций увеличивается в два - четыре раза.
Математически это правило может быть выражено уравнением:
v 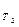 = v
= v 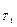 ∙
∙ 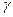
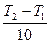
где 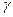 - температурный коэффициент скорости реакции;
- температурный коэффициент скорости реакции;
v 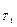 v
v 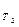 - скорости реакции при температуре T1 и T2.
- скорости реакции при температуре T1 и T2.
Например, если 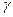 = 2 и T2 - T1 = 1000, то
= 2 и T2 - T1 = 1000, то 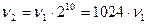 , т.е. скорость реакции при повышении температуры на 1000 увеличивается приблизительно в 1000 раз.
, т.е. скорость реакции при повышении температуры на 1000 увеличивается приблизительно в 1000 раз.
Энергия активации. При концентрации реагирующих веществ 1 моль/л скорость реакции численно равна константе скорости К. Уравнение Вант - Гоффа примет вид:
K 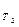 = K
= K 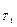 ∙
∙ 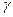
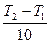
Это уравнение показывает, что К зависит от температуры также как и скорость.
Это уравнение лишь приближенно оценивает зависимости 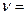 f (T) и K = f (T). Функциональную зависимость константы скорости химической реакции от температуры установил в 1889 году шведский ученый С. Аррениус:
f (T) и K = f (T). Функциональную зависимость константы скорости химической реакции от температуры установил в 1889 году шведский ученый С. Аррениус:
K = A 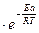
где е - основание натуральных логарифмов (e = 2.718…);
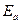 - энергия активации;
- энергия активации;
R - газовая постоянная;
T - температура;
A - предэкспоненциональный множитель (постоянный для данного случая).
После логарифмирования уравнение принимает вид:
ln K = - 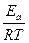 + ln A
+ ln A
Из этого уравнения следует, что зависимость константы скорости химической реакции от температуры, построенная в координатах ln K - 1/Т, линейна. Эта зависимость позволяет определить энергию активации реакции 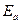 по тангенсу угла наклона прямой и предэкспоненциальный множитель А по отрезку, отсекаемому прямой на оси ординат, когда 1/Т = 0 (рис. 48)
по тангенсу угла наклона прямой и предэкспоненциальный множитель А по отрезку, отсекаемому прямой на оси ординат, когда 1/Т = 0 (рис. 48)
В уравнение Аррениуса входят две величины Е и А, являющиеся некоторыми характеристиками каждой реакции.
Необходимым условием начала химического взаимодействия между двумя молекулами должно быть их соударение. Однако не все соударения эффективны. Реагируют только те молекулы (активные молекулы), которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных частицах и тем самым образовать новые связи. Поэтому каждая реакция характеризуется определенным энергетическим барьером; для его преодоления необходима энергия активации. Этот барьер можно представить графически (рис. 49), который показывает относительные энергии реагирующих веществ и продуктов реакции.
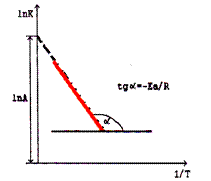 |
Рис. 48. Зависимость ln K от 1/T
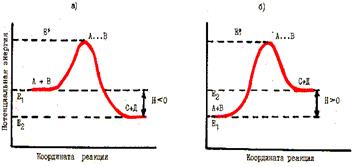
Рис. 49. Энергетические диаграммы
для экзо - реакции (а) и для эндо - реакции (б)
Все молекулы в системе, запас энергии, которых не ниже энергетического барьера реакции, находятся в особом состоянии, которое принято называть переходным или состоянием активированного комплекса. Можно предположить, что система в состоянии активированного комплекса характеризуется тем, что в ней уже нет исходных веществ, но нет еще и продуктов реакции. Схематический переход от исходных веществ А и В к продукции реакции С и Д через состояние активированного комплекса А … В представлен на рис. 49.
В качестве примера на рис. 50 представлена диаграмма, которая иллюстрирует реакцию между окисью углерода СО и двуокисью азота NO2 с образованием двуокиси углерода СО2 и окиси азота NO. Из рисунка видно, что энергия активация 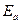 - это энергия, необходимая для превращения реагирующих веществ в состояние активированного комплекса.
- это энергия, необходимая для превращения реагирующих веществ в состояние активированного комплекса.
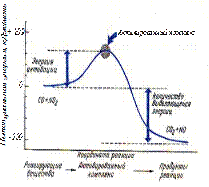
Рис. 50. Диаграмма потенциальной энергии
для реакции CO + NO2 → CO2 + NO
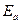 - зависит от природы реагирующих веществ. Чем больше энергия активации, тем меньше скорость реакции.
- зависит от природы реагирующих веществ. Чем больше энергия активации, тем меньше скорость реакции.
Обычно реакции между веществами с прочными связями характеризуются большими значениями 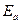 и идут медленно, например
и идут медленно, например
N2O4→2NO2 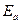 = 54,4 кдж/моль
= 54,4 кдж/моль
H2 + I2 →2HI 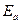 = 165,5 кдж/моль
= 165,5 кдж/моль
Реакции, для которых 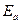 > 150 кдж/моль при комнатной температуре не протекают.
> 150 кдж/моль при комнатной температуре не протекают.
Малыми значениями 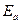 и очень большими скоростями характеризуются ионные взаимодействия в растворах электролитов, например:
и очень большими скоростями характеризуются ионные взаимодействия в растворах электролитов, например:
Ba2+ + SO 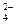 → BaSO4
→ BaSO4
Это связано с тем, что разноименно заряженные ионы притягиваются друг к другу и не требуется затрачивать энергию на преодоление сил отталкивания взаимодействующих частиц.
Множитель А в уравнении Аррениуса должен отвечать общему числу соударений молекул Z реагирующих веществ в единицу объема за единицу времени. Для химического взаимодействия молекулам необходим не только избыток энергии, равный 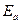 , но еще и определенная их взаимная ориентация. Влияние пространственной ориентации молекул на скорость реакции может быть учтена с помощью так называемого стерического фактора Р:
, но еще и определенная их взаимная ориентация. Влияние пространственной ориентации молекул на скорость реакции может быть учтена с помощью так называемого стерического фактора Р:
A = P ∙ Z
Значение Р обычно лежат в пределах от 10-9 до 1. При этом малые величины Р отвечают чаще всего реакциям между сложными по своей структуре органическими соединениями.
Скорость гетерогенных химических реакций. Реакция в гетерогенной системе осуществляется на поверхности раздела фаз. Средняя скорость гетерогенной химической реакции равна
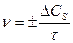
где СS - поверхностная концентрация, измеряется количеством молей веществ, приходящихся на единицу реакционной поверхности (моль/м2 или моль/см2).
Зависимость скорости гетерогенной химической реакции от поверхностной концентрации реагентов, так же как и зависимость скорости галогенной реакции от объемной концентрации, определяется законом действия масс.
Например, зависимость скорости процесса
CaO (k) + CO2 (г) → CaCO3 (k)
при Т = const от поверхностной концентрации CO2 имеет вид:
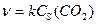 ,
,
где 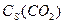 - поверхностная концентрация CO2, моль/м2
- поверхностная концентрация CO2, моль/м2
В некоторых случаях вычисляют скорость гетерогенного процесса, используя вместо поверхностной концентрации объемную концентрацию.
Например:
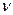 = k ∙ C (CO2)
= k ∙ C (CO2)
где 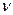 - скорость реакции, моль/л с;
- скорость реакции, моль/л с;
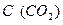 - объемная концентрация СО2.
- объемная концентрация СО2.
Колебательные реакции. Колебательные или периодические реакции характеризуются колебаниями концентрации некоторых промежуточных соединений и соответственно скоростей превращения. Наблюдаются в газовой и жидкой фазах (особенно часто на границе раздела этих фаз с твердой фазой). Колебательными чаще всего бывают окислительно-восстановительные реакции, а также реакции, сопровождающиеся появлением новой фазы вещества. Причина возникновения колебаний концентрации - наличие обратных связей между отдельными стадиями сложной реакции: положительных, когда продукт реакции ускоряет ее (например, в разветвленных цепных стадиях, при автокатализе, саморазогреве), и отрицательных, когда в ходе реакции вырабатывается ингибитор ее начальных стадий.
Колебания часто возникают при работе промышленных проточных реакторов (например, при полимеризации этилена, окисление СО). Обычно они вредны, снижают однородность продукта, приводят к аварийным ситуациям. Однако в некоторых случаях проведение реакции в колебательном режиме может увеличить выход продукта. Колебательные реакции лежат в основе ряда важнейших биологических процессов; генерации нервных импульсов, мышечного сокращения, генерации биоритмов.
Химическое равновесие
Многие химические реакции протекают обратимо. Их особенность состоит в том, что они не идут до конца, в системе всегда остается (в большем или меньшем количестве) каждое из исходных веществ. В ходе обратимой химической реакции концентрации исходных веществ уменьшаются, а продуктов - возрастают. Это сопровождается увеличением скорости обратной реакции 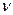 ← и уменьшением скорости прямой реакции
← и уменьшением скорости прямой реакции 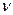 →. Если в системе наступает состояние, при котором
→. Если в системе наступает состояние, при котором 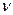 → =
→ = 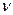 ←, то его называют химическим равновесием.
←, то его называют химическим равновесием.
Истинное химическое равновесие характеризуется тремя признаками: в системе не происходит видимых во времени изменений при отсутствии внешнего воздействия; равновесие достигается как при прямой, так и при обратной реакции (рис. 51), самое малое внешнее воздействие легко и незначительно смещает равновесие в ту или в другую сторону.
Примером обратимой реакции является образование иодоводорода:
H2 + I2 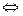 2HI
2HI
которая при 4440 С и давлением в 0,1 МПа прекращается после образования 78 % НI. Эта концентрация отвечает состоянию химического равновесия. Не изменяя температуры и давления, нельзя получить больше, чем 78 % НI.
В случае обратимой химической реакции
aA + bB 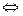 cC + dD
cC + dD
Зависимость скоростей прямой ( 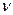 →) и обратной (
→) и обратной ( 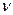 ←) реакции от концентраций реагирующих веществ выражается соотношениями
←) реакции от концентраций реагирующих веществ выражается соотношениями
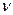 → = K→ ∙ [A] a ∙ [B] b
→ = K→ ∙ [A] a ∙ [B] b
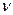 ← = K ← ∙ [C] c ∙ [D] d
← = K ← ∙ [C] c ∙ [D] d
В состоянии химического равновесия 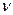 → =
→ = 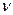 ←, т.е.
←, т.е.
K→ ∙ [A] a ∙ [B] b = K ← ∙ [C] c ∙ [D] d
Отсюда
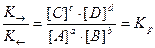
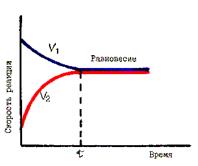
Рис. 51. Установление химического равновесия
где Kp - константа равновесия реакции. Kp - основная количественная характеристика химического равновесия.
Концентрации, входящие в выражение константы равновесия, называются равновесными концентрациями. Kp - постоянная при данной температуре величина, выражающая соотношение между равновесными концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель). Чем больше Kp, тем более глубоко протекает реакция, т.е. тем больше выход ее продуктов. Kp зависит от природы реагентов, температуры и не зависит от исходных концентраций веществ в системе.
Например, для реакции:
4HCl + O2  2Cl2 + 2H2O Kp = 1,2 ∙ 1016
2Cl2 + 2H2O Kp = 1,2 ∙ 1016
Для реакции диссоциации угольной кислоты
H2CO3  H+ + HCO
H+ + HCO 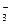 Kp = 4,4 ∙ 10-7
Kp = 4,4 ∙ 10-7
Если обратимая реакция протекает в гетерогенной системе, например
FeO (к) + CO (г) 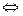 Fe (к) + CO2 (г),
Fe (к) + CO2 (г),
то константа равновесия Kp равна отношению равновесных парциальных давлений газообразных веществ (CО2 и СО) и не зависит от абсолютных и относительных количеств веществ, находящихся в конденсированной фазе (Fe и FeO):
Kp = 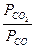
Зависимость Kp от температуры при p = const выражается уравнением изобары химической реакции:
ln Kp = 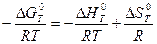
Если 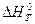 < 0,то константа равновесия при повышении температуры уменьшается. Если
< 0,то константа равновесия при повышении температуры уменьшается. Если 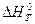 > 0 (эндотермическая реакция), то величина Kp при повышении температуры увеличивается.
> 0 (эндотермическая реакция), то величина Kp при повышении температуры увеличивается.
Зависимость константы равновесия от температуры при V = const выражается уравнением изохоры химической реакции:
ln Kp = 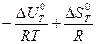
Принцип Ле Шателье. При изменении условий протекания реакции (T, P, C какого либо из веществ) скорости прямого и обратимого процессов изменяются неодинаково и химическое равновесие нарушается. В результате преимущественного протекания реакции в одном из возможных направлений устанавливается состояние нового химического равновесия, отличающееся от исходного. Процесс перехода от одного равновесного состояния к новому равновесию называется смещением химического равновесия. Направление этого смещения подчиняется принципу Ле Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Так повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты, т.е. охлаждением системы.
Например, для обратимой экзотермической реакции
N2 (г) + 3H2 (г) 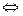 2NH3 (г),
2NH3 (г), 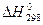 = - 91 кДж
= - 91 кДж
Повышение температуры будет смещать равновесие влево, в сторону разложения аммиака на N2 и Н2. Например, выход аммиака для этой реакции при 300 0С и 20 МПа составляет 64%, а при 600 0С и том же давлении - всего 8 %.
Повышение давления вызывает смещение равновесия в направлении уменьшения общего числа молей газообразных веществ, т.е. в направлении, приводящем к понижению давления. При увеличении давления, например, в реакции синтеза аммиака (рассмотренной выше), выход продукта возрастает. В частности при 300 0С и при давлении 100 МПа выход аммиака достигает 92 %.
При увеличении концентрации, например, исходных веществ сдвиг равновесия произойдет в сторону образования продуктов реакции. Например, при увеличении концентрации азота или водорода равновесие реакции сместится в сторону образования аммиака.
Константа равновесия Kp химической реакции связана со стандартным изменением энергии Гиббса этой реакции 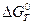 уравнением:
уравнением:
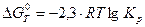
При 298 К это уравнение имеет вид:
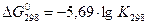
Видно, что Δ G < 0 в том случае, если 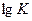 > 0, т.к. K > 1, а положительный (Δ G0 > 0), если
> 0, т.к. K > 1, а положительный (Δ G0 > 0), если 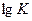 < 0, т.е. K < 1. Это значит, что при отрицательных значениях Δ G0 равновесие смещено в направлении прямой реакции и выход продуктов реакции сравнительно велик; при Δ G0 > 0 равновесие смещено в сторону обратной реакции и выход продуктов прямой реакции сравнительно мал.
< 0, т.е. K < 1. Это значит, что при отрицательных значениях Δ G0 равновесие смещено в направлении прямой реакции и выход продуктов реакции сравнительно велик; при Δ G0 > 0 равновесие смещено в сторону обратной реакции и выход продуктов прямой реакции сравнительно мал.
Цепные реакции

Молекула A ↑↓ B с ковалентной связью между атомами А и В в активированном состоянии может распадаться на ионы:


A ↑↓ B→A++ ↑↓ B-(а),
а также и атомы (или свободные радикалы):



A ↑↓ B → A ↑ + ↓ B (б)
В реакции (а) разрыв связи называется гетеролическим или ионным, в реакции (б) гомолитическим или радикальным.
Существует два типа цепных реакций; с неразветвленными и разветвленными цепями. Примером с разветвленными цепями может служить фотохимический синтез хлорида водорода, который протекает со взрывом при облучении смеси водорода и хлора солнечным светом. Для цепных реакций характерны три стадии;
а) стадия зарождения цепи

 Cl2 + h
Cl2 + h 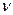 →Cl ↓ + ↑ Cl
→Cl ↓ + ↑ Cl
б) стадия развития цепи

 Cl ↓ + H2 → HCl + ↓ H
Cl ↓ + H2 → HCl + ↓ H


H ↓ + Cl2 → HCl + ↓ Cl и т. д.
в) стадия обрыва цепи (столкновения двух атомов)


H ↓ + ↑ H → H2


Cl ↓ + ↑ Cl → Cl2


H ↓ + ↑ Cl → HCl
Цепные реакции с разветвленными цепями протекают так, что каждая активная частица порождает не одну, как в неразветвленной цепи, а минимум две новые активные частицы.
Примером реакции с разветвленными цепями может служить окисление водорода, протекающее при определенных условиях по цепному механизму.
Если пропустить через смесь равных объемов водорода и кислорода электрический заряд (h 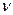 ), то произойдет образование двух свободных радикалов
), то произойдет образование двух свободных радикалов

H2 + O2 → 2 HO ↓ ,
каждый из которых характеризуется высокой активностью.
Новый акт взаимодействия протекает самопроизвольно:


HO ↓ + H2 → H2O + H ↓ ,

 |

 И далее H ↓ + O2
И далее H ↓ + O2
 HO ↓ + H2
HO ↓ + H2

 H2O
H2O


 H ↓ + O2
H ↓ + O2



 H ↓ + O2
H ↓ + O2


 ↓ O ↓ + H2
↓ O ↓ + H2
 HO ↓ + H2
HO ↓ + H2
По цепному механизму протекают многие химические реакции, например, крекинг и полимеризация, образование смога в атмосфере и др.
Фазовые равновесия
Гетерогенные равновесия, связанные с переходом вещества из одной фазы в другую без изменения химического состава, называются фазовыми. К их числу можно отнести равновесия в процессах испарения, плавления, конденсации. Для фазовых равновесий справедлив принцип Ле Шателье. Например, H2O (ж) 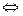 H2O (г)
H2O (г)
Одним из наиболее общих законов гетерогенных (в том числе и фазовых) равновесий является правило фаз. Согласно этому правилу в равновесной системе число фаз Ф, число независимых компонентов К и число степеней свободы связаны соотношением:
С + Ф = К + n,
где n - число внешних факторов, влияющих на равновесие системы. Внешними факторами чаще всего бывают температура и давление, тогда n = 2 и уравнение принимает вид:
С + Ф = К + 2
Число термодинамических степеней свободы С равно числу условий (T, P и С), произвольное которых в известных пределах не меняет числа и вида фаз системы.
По числу степеней свободы системы делят на инвариантные (С = 0), моновариантные (С = 1), бивариантные (С = 2) и поливариантные (С > 2).
К - число компонентов, равно общему числу видов молекул минус число независимых химических реакций.
Пример 1. В гетерогенной системе медь - кислород два компонента. Она состоит из четырех различных веществ: Cu, CuO, Cu2O, O2, т. е. из четырех фаз реакции:
2Cu + O2 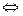 2CuO
2CuO
4Cu + O2 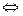 2Cu2O
2Cu2O
Итак, в этой системе имеют место две реакции и число компонентов K = 4 – 2 = 2. Число степеней свободы по графику фаз C = 2 + 2 – 4 = 0. Такая система существует при строго определенной температуре давления кислорода. Система инвариантна (рис. 52).
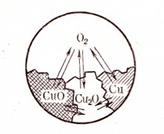 |
Рис. 52. Схема гетерогенного равновесия
окисления меди кислородом
Пример 2. В системе из диссоциирующего карбоната кальция три фазы и два компонента:
CaCO3 → CaO (Т) + CO2 (Г)
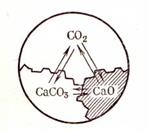 |
Число степеней свободы C = 2 + 2 – 3 = 1. Система моновариантная (рис. 53).
Рис. 53. Схема обратимой реакции
диссоциации карбоната кальция
За степень свободы можно принять или температуру, или давление, т. к. эти параметры функционально связанны:
P  = f1 (T); T = f2 (P
= f1 (T); T = f2 (P  )
)
Если 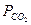 является только температурной функцией, то его можно принять за константу равновесия.
является только температурной функцией, то его можно принять за константу равновесия.
Пример 3. Равновесная система из твердого углерода, оксида и диоксида углерода имеет две фазы и два компонента (K = 3 – 1 = 2):
C (Г) + CO2 (Г)  2CO (Г)
2CO (Г)
Число степеней свободы по правилу фаз C = 2 + 2 – 2 = 2. Система бивариантная. В данной системе давление СО2 зависит от температуры и давления или от концентрации СО (рис. 54).
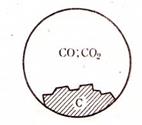 |
Рис. 54. Схема равновесия между твердым
углеродом, CO и CO2
При изучении фазовых равновесий широко применяется графический метод построения диаграмм состояния.
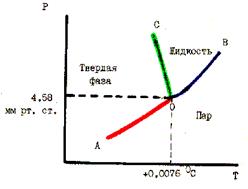
Рис. 55. PT - диаграмма состояния воды
Например, на рис. 55 представлена диаграмма для воды в координатах Р - Т. Линии АО и ОВ ограничивают область пара, линии ОВ и ОС - область жидкости и линии АО и ОС - область твердой фазы. Эта диаграмма описывает фазовые равновесия только при низком давлении.
В любой области однофазной системы С = K + 2 – Ф = 1 + 2 – 1 = 2, т. е. в таких системах можно произвольно изменять два параметра (Р и Т) в некоторых пределах без изменения числа фаз. Это бивариантные системы. Для любой точки на одной из линий - ОА, ОВ, ОС, которые соответствуют равновесию двух фаз число степеней свободы С = 1 + 2 – 2 = 1. Это
моновариантные системы в которых можно изменять один параметр (Р или Т). При наибольшем возможном числе фаз, равном 3, в системе в условиях, определяющих тройную точку О, не остается ни одной степени свободы (С = 0). Это нонвариантная система. Для воды тройная точка отвечает Т = 0,00760 С и Р=4,58 мм. рт. ст. При насыщении воды воздухом с давлением 1 атм. Равновесие воды льда и пара наступает при 00 С. Из рис. 55 видно, что с повышением давления температура плавления льда снижается ( линия ОС наклонена влево). Это является следствием большей плотности воды по сравнению с плотностью льда при равновесии. По принципу Ле Шателье равновесие лед 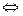 вода - 6,1 кДж/моль при увеличении давления смешается в сторону воды, имеющей меньший объем. Если теперь при повышенном давлении повышать температуру, то равновесие должно смещаться в сторону льда (с выделением теплоты).
вода - 6,1 кДж/моль при увеличении давления смешается в сторону воды, имеющей меньший объем. Если теперь при повышенном давлении повышать температуру, то равновесие должно смещаться в сторону льда (с выделением теплоты).
