Определение общей жесткости воды
Общую жесткость воды определяют комплексонометрическим титрованием. Метод основан на применении специального реактива - трилона Б (двузамещенная натриевая соль этилендиаминтетрауксусной кислоты):
HOOCH2С CH2COONa
\ /
N – CH2 – CH2 – N × 2H2O
/ \
NaOOCH2С CH2COOH
В основе метода лежит способность трилона Б образовывать прочные комплексы с катионами многих металлов, в том числе с кальцием и магнием.
Схематически данное взаимодействие может быть выражено уравнением:
Ca2+ + Na2H2R = Na2(CaR) + 2H+ ,
где R – радикал этилендиаминтетрауксусной кислоты.
Течению реакций благоприятствует слабощелочная среда, которая создается прибавлением аммиачного буферного раствора. Он представляет собой смесь слабого основания NH4OH c его солью NH4Cl и обладает способностью поддерживать рН раствора практически постоянным.
Если в раствор, содержащий ионы кальция или магния, ввести индикатор, дающий цветные соединения с этими ионами, то при добавлении трилона Б к такому окрашенному раствору произойдет изменение окраски в эквивалентной точке.
В качестве индикатора применяют хромоген черный.
Ход определения
В две конические колбы с помощью мерной посуды отмеряют по 100 мл водопроводной воды. Добавляют в эти же колбы по 5 мл буферной смеси и на кончике шпателя – индикатор хромоген черный до получения винно-красной окраски. Одна из колб служит контрольной. Далее титруют пробу из бюретки раствором трилона Б до тех пор, пока от одной капли трилона Б окраска перейдет из винно-красной в синюю. Титрование повторяют с новой порцией воды и при сходных результатах между двумя значениями объема трилона Б, пошедшего на титрование (разница не более 0,2 мл), находят среднее арифметическое значение.
Расчет общей жесткости воды производят по формуле
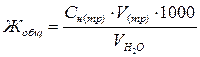 , (2)
, (2)
где Жобщ.– общая жесткость воды, ммоль/л; С н(тр) – нормальная концентрация трилона Б, моль/л; V(тр) – объем трилона Б, израсходованный на титрование, мл; 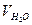 – объем исследуемой пробы воды, мл.
– объем исследуемой пробы воды, мл.
Постоянную (некарбонатную) жесткость воды находят по разности общей и временной (карбонатной) жесткости
Жпост.= Жобщ.– Жвр. (3)
По полученным данным характеризуют жесткость исследуемой воды.
Вопросы для самоконтроля и повторения
1. В чем суть качественного химического анализа?
2. С помощью каких реагентов можно обнаружить катионы Fe+3 и Fe+2?
3. С помощью какого реагента можно различить растворы солей, содержащих анионы Cl-, Br-, S2-?
4. Какой количественный метод химического анализа используют для определения временной жесткости воды?
5. Каким методом определяют общую жесткость воды?
6. В чем суть титриметрического метода анализа?
Глава 7. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Лабораторная работа № 17
Адсорбция. Адсорбционное равновесие
Цель работы: определение адсорбционных характеристик различных сорбентов.
Теоретическая часть
Межфазные, или поверхностные,явления – это явления, которые возникают и протекают на границе раздела фаз, в межфазном поверхностном слое (рис. 1,2). Межфазные явления обусловлены тем, что молекулы, атомы или ионы, находящиеся на поверхности раздела фаз, неравноценны молекулам, атомам или ионам, находящимся внутри фазы, так как они обладают избыточной энергией, называемой свободной поверхностной энергией или поверхностным натяжением (s),если эта энергия относится к единице поверхности (sизмеряется в СИ Дж/м2 или Н/м).
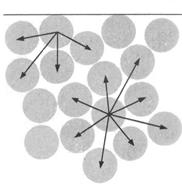
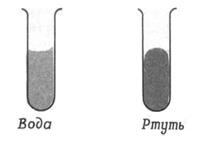
Рис. 1.Объяснение на молекулярном уровне Рис. 2 Формы менисков воды и ртути
причин возникновения поверхностного натя- в стеклянных трубках
жения: межмолекулярные силы, действующие
на молекулу, находящуюся вблизи поверхности
жидкости, не уравновешивают друг друга
Поверхностное натяжение (s) является важной физико-химической характеристикой твердых и жидких тел. При постоянной температуре эта величина характеризует полярность жидкости. При рассмотрении поверхностных явлений полярность означает интенсивность поля молекулярных сил и связана с такими параметрами жидкости, как дипольный момент, поляризуемость, диэлектрическая проницаемость.
Поверхностная энергия, зависящая от состава жидкой фазы и от температуры, представлена термодинамической функцией – свободная энергия Гиббса для поверхности:
DGпов = DHпов – TDSпов = s ´ S, (1)
где DGпов – энергия Гиббса; DHпов – энтальпия поверхности;DSпов – энтропия поверхности; s – поверхностное натяжение; S – площадь поверхности.
При достижении равновесия DGпов стремится к минимальному значению. Уменьшение энергии Гиббса для поверхности в изотермических условиях может быть получено за счет уменьшения поверхности (например, стягивания капли) или за счет снижения поверхностного натяжения (адсорбция, изменение состава жидкости). Оба фактора могут действовать одновременно.
Следовательно, поверхностное натяжение характеризуют силы межмолекулярного взаимодействия, количественно выраженные работой по переводу соответствующего числа молекул из объема в поверхностный слой раздела фаз.
Поверхностное натяжение зависит от следующих факторов:
- химической природы вещества (табл.1);
- температуры.
Таблица 1
Поверхностное натяжение некоторых жидкостей
| Название | Формула | Т, К | s, Дж/м2 |
| Водород | Н2 | 14,9 | 0,00283 |
| Аргон | Ar | 84,9 | 0,0132 |
| Кислород | О2 | 90,0 | 0,0183 |
| Метан | СН4 | 93,0 | 0,0180 |
| Бензол | С6Н6 | 293,0 | 0,02887 |
| Вода | Н2О | 293,0 | 0,07275 |
| Этанол | С2Н5ОН | 293,0 | 0,02203 |
| Глицерин | С3Н8О3 | 291,0 | 0,06247 |
| Анилин | С6Н5NH2 | 293,0 | 0,04366 |
| Хлорид серебра | AgCl | 723,0 | 0,125 |
| Карбонат натрия | Na2CO3 | 1124,0 | 0,914 |
| Алюминий | Al | 933,0 | 0,914 |
| Железо | Fe | 1812,0 | 1,84 |
| Медь | Cu | 1356,0 | 1,351 |
С повышением температуры (Т) s уменьшается за счет ослабления межмолекулярного взаимодействия. При критической температуре (Ткрит.) граница между жидкостями исчезает и s = 0.
Все вещества делятся на инактивные (кислоты, соли, щелочи) и поверхностно-активные вещества (ПАВ), к которым относятся спирты, органические кислоты, амины, фенолы, белки и т.д. При увеличении концентрации инактивного вещества поверхностное натяжение увеличивается. Если увеличивается концентрация поверхностно активного вещества, поверхностное натяжение уменьшается (рис.3).
 |
 s 3
s 3
 |

С
Рис.3.Влияние концентрации (С) на поверхностное натяжение (s):
1,2 – система бензол-вода; 3 – система соль-вода
Концентрация бензола в системе 2 выше, чем в системе 1.
Ценные практические свойства ПАВ обусловили интенсивное развитие их производства и все более широкое внедрение в разнообразные отрасли народного хозяйства. ПАВ – это моющие средства, эмульгаторы в процессах эмульсионной полимеризации, текстильно-вспомогательные средства в процессах отделки тканей, флотореагенты при обогащении руд и углей, деэмульгаторы при обезвоживании и обессоливании нефтей, необходимые компоненты смазочно-охлаждающих жидкостей, пластических смазок, стабилизаторы различных дисперсных систем.
Поверхностная энергия стремится самопроизвольно уменьшиться. Это выражается в уменьшении межфазной поверхности, или поверхностного натяжения. К явлениям, происходящим вследствие стремления к самопроизвольному снижению поверхностного натяжения, относится адсорбция.
Сорбция–процесс поглощения одного вещества (сорбата) другим (сорбентом). Если вещество поглощается всем объемом другого вещества, то происходит абсорбция, если только поверхностью – адсорбция.
Таким образом, адсорбцией называется изменение концентрации адсорбата в поверхностном слое по сравнению с объемной фазой, отнесенное к единице поверхности адсорбента (г/м2, моль/м2). Часто из-за сложности определения величины поверхности адсорбентов количество адсорбированного вещества относят к единице массы (г/г, моль/г).
Различают два вида адсорбции: физическую, осуществляемую за счет сил Ван-дер-Ваальса, и химическую, или хемосорбцию, осуществляемую за счет сил химической природы, действующих между компонентом и поверхностным слоем.
Адсорбция является экзотермическим процессом, т. е. сопровождается убылью энтальпии (DН < 0). Следовательно, согласно принципу Ле-Шателье, с повышением температуры адсорбция уменьшается. Для каждой температуры характерно свое состояние адсорбционного равновесия. Величина энтальпии, определенная для процесса адсорбции, называется энтальпией адсорбции (DH < 0) или теплотой адсорбции (Q > 0).
При адсорбции смеси веществ у границы раздела фаз будет накапливаться тот компонент, время адсорбции которого больше.
Адсорбция представляет собой процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой. При адсорбции в многокомпонентных системах в поверхностный слой предпочтительнее переходит тот компонент, который сильнее уменьшает межфазное (поверхностное) натяжение.
Вещество, которое поглощается или концентрируется на поверхности раздела фаз, называется адсорбтивом (для жидкостей) или адсорбатом (для газов). Вещество, на поверхности которого происходит концентрация адсорбтива (адсорбата), называется адсорбентом. Величина адсорбции а определяется количеством адсорбтива (адсорбата) n к единице площади поверхности S адсорбента и выражается в киломолях на квадратный метр (кмоль/м2)
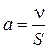 (2)
(2)
или количеством адсорбтива (адсорбата) n к единице его массы m и выражается в киломолях на килограмм (удельная адсорбция)
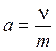 . (3)
. (3)
При установлении равновесия в системе количество адсорбированного вещества в поверхностном слое находится в определенной зависимости от концентрации (или парциального давления) этого компонента в объеме и от температуры. Число параметров, определяющих состояние системы, легко получить, применив правило фаз Гиббса:
Ст = К – Ф + 2, (4)
где Ст – число степеней свободы;
К – число компонентов в системе; Ф – число фаз;
2 – число параметров (давление или концентрация и температура).
В простейшем случае, при адсорбции из газовой фазы, система состоит из адсорбента и газа-адсорбата. Для этой системы число компонентов равно 2, число фаз составляет 2 и в соответствии с правилом фаз Гиббса число степеней свободы также равно 2. Это значит, что можно произвольно изменять два параметра (давление и температуру), при определенных значениях которых фиксируется равновесное состояние системы. Если система состоит из конденсированных фаз (твердой и жидкой), то адсорбируется растворенное вещество и число компонентов в ней будет равно 3. Обычно для конденсированной системы пренебрегают влиянием давлениям, и тогда в ней число степеней свободы также оказывается равным 2. Это означает, что можно произвольно изменять два параметра: концентрацию и температуру. Таким образом, любой из параметров системы однозначно может быть определен как минимум через два других параметра. Как следует из примеров, этими параметрами могут быть концентрация (давление) адсорбтива (адсорбата) и температура.
Зависимость адсорбции от концентрации (a = f(C)) при T = const называют изотермой. Так как изотерма адсорбции по своему виду напоминает параболу, то Г. Фрейндлих предложил эмпирическое уравнение следующего вида:
в случае адсорбции газа
а = K × pn ; (5)
в случае адсорбции из раствора
а = К × Сп, (6)
где С – равновесная концентрация; К, п – эмпирические константы, характерные для данной системы.
Константы К и п определяются опытным путем, они характеризуют пригодность адсорбента для данного случая адсорбции. Величина К колеблется в широких пределах, п – характеризует степень приближения изотермы к прямой и изменяется для газов от 0,2 до 1,0; для растворов – от 0,1 до 0,5.
Если принять п = 1, то а = К × С, т. е. величина адсорбции прямо пропорциональна концентрации (давлению), В этом случае уравнения (5), (6) выражают закон Генри. Если п = 0, то а = К, т. е. величина адсорбции постоянна. Уравнение Фрейндлиха справедливо только для растворов средних концентраций адсорбтива. По уравнению Фрейндлиха невозможно рассчитать предельную адсорбцию. Для средних концентраций константы К и п могут быть найдены графическим методом (рис. 4).
 |
Рис. 4.Зависимость lg a = f(lgC)
Путем логарифмирования уравнения (6) получаем уравнение прямой
lga = lgK + n × lgC. (7)
На графике зависимости lga = f(lgC) отрезок ОА равен lgK, величина n соответствует tga (рис. 4).
