Элементарная химическая реакция
Элементарная химическая реакция протекает в одну стадию при непосредственном взаимодействии молекул исходных веществ друг с другом. Она представляет собой совокупность элементарных химических актов, каждый из которых есть процесс превращения одной или нескольких находящихся в контакте частиц исходных веществ в частицы продуктов. Элементарный химический акт происходит за отрезки времени t ~ 10-13 – 10-15 с.
Рассмотрим химическую реакцию, элементарным актом которой является взаимодействие молекул A2 и B2 с образованием двух молекул АВ: A2 + B2 ® 2 АВ. Условием осуществления этого элементарного химического акта является, во-первых, встреча (столкновение) молекул A2 и B2. Под встречей подразумевается сближение этих молекул на расстояние, позволяющее эффективно взаимодействовать их электронным оболочкам. То есть, взаимодействующие молекулы должны одновременно оказаться в некотором элементарном объеме пространства – месте встречи. Во-вторых, наличие у молекул A2 и B2 достаточной энергии для образования ими нестабильной промежуточной частицы, в состав которой будут входить два атома А и два атома В, объединенные общей системой химических связей, которая в дальнейшем распадется на две молекулы АВ.
Область пространства, в которой происходят элементарные акты химической реакции, называется реакционным пространством. Для гомогенных реакций, в которых реагирующие вещества (А2 и B2) находятся в одной фазе (взаимодействие газов или смешивающихся жидкостей), элементарные акты взаимодействия возможны в любой точке объема, занимаемого реагентами. В этом случае объем и является реакционным пространством (V). В случае гетерогенных реакций реагирующие вещества находятся в разных фазах (например, взаимодействие твердых веществ с газами или жидкостями). Элементарные акты химического взаимодействия протекают на границе раздела фаз, которая и является реакционным пространством – реакционная поверхность (S). Число частиц, участвующих в элементарном химическом акте, называется молекулярностью реакции. Соответственно различают реакции:
· мономолекулярные, например С2H6®2СH3·,
· бимолекулярные, например 2NO2® N2O4, H· + O2 ® OH· + O·,
· тримолекулярные, например 2NO + O2 ® 2NO2.
Тримолекулярные реакции встречаются крайне редко, а реакции более высокой молекулярности не протекают. Это связано с пренебрежимо малой вероятностью встречи четырех и более частиц.
Скорость химической реакции
Под скоростью элементарной химической реакции подразумевается число элементарных актов (r), совершающихся в единицу времени в единице реакционного объема (для гомогенных реакций 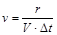 ) или на единице реакционной поверхности (для гетерогенных реакций
) или на единице реакционной поверхности (для гетерогенных реакций 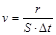 ). Непосредственно определить число элементарных актов достаточно трудно (или невозможно). Поэтому обычно скорость реакции выражают через величины, пропорциональные числу элементарных актов. Для гомогенных реакций такими величинами являются изменения молярных концентраций реагирующих веществ (число молей в единице объема).
). Непосредственно определить число элементарных актов достаточно трудно (или невозможно). Поэтому обычно скорость реакции выражают через величины, пропорциональные числу элементарных актов. Для гомогенных реакций такими величинами являются изменения молярных концентраций реагирующих веществ (число молей в единице объема).
Пусть протекает гомогенная реакция, элементарный акт которой описывается уравнением nAA + nBB ® nDD. Из уравнения реакции вытекает, что в элементарном акте расходуется nA молекул вещества A и nВ молекул вещества В с образованием nD молекул вещества D. Скорость реакции может быть определена как
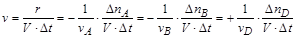 ,
,
где Dni – число частиц i-го вещества, взаимодействующих за интервал времени Dt в объеме V, ni – стехиометрические коэффициенты.
Отметим, что для простой реакции стехиометрические коэффициенты совпадают с числом частиц каждого вещества, участвующих в элементарном акте. Знак "минус" указывает на то, что вещество расходуется, а знак "плюс" – что оно накапливается в ходе реакции.
Обычно указывается изменение количества i-го вещества в единицу времени (скорость накопления или расходования). Если учесть, что за время реакции Dt = t2–t1 изменение числа частиц реагентов в единице объема ( 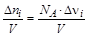 ) пропорционально изменению их молярных концентраций (
) пропорционально изменению их молярных концентраций ( 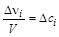 [моль/л]), то среднюю скорость реакции можно выразить через изменение молярной концентрации i-го вещества. Тогда
[моль/л]), то среднюю скорость реакции можно выразить через изменение молярной концентрации i-го вещества. Тогда
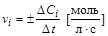 .
.
Мгновенная (истинная) скорость реакции определяется при Dt®0:
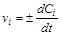 .
.
В смесях газов число частиц компонентов в единице объема пропорционально их парциальному давлению (pi):
Dni =Dni×NА,Dpi×V =Dni×RT
(Dni – изменение числа молей i-го газа; V – объем газовой смеси).
Таким образом, для гомогенных реакций между газами скорость химической реакции можно выразить через изменение парциального давления i-го газа:
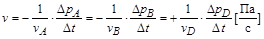 .
.
Соответственно при Dt®0 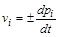 .
.
