Полярность связи. Дипольный момент молекулы
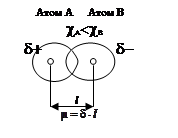 При образовании ковалентной химической связи между разными атомами (гетероядерные молекулы) электронная плотность распределяется не симметрично относительно ядер. В молекуле она сдвинута в сторону атома, имеющего большее значение электроотрицательности. Вследствие этого в двухатомной молекуле центры тяжести положительных зарядов ядер и отрицательных зарядов электронов не совпадают. Возникает система разных по знаку, но одинаковых по величине электрических зарядов (d+ и d-) – электрический диполь (рис. 2.23).
При образовании ковалентной химической связи между разными атомами (гетероядерные молекулы) электронная плотность распределяется не симметрично относительно ядер. В молекуле она сдвинута в сторону атома, имеющего большее значение электроотрицательности. Вследствие этого в двухатомной молекуле центры тяжести положительных зарядов ядер и отрицательных зарядов электронов не совпадают. Возникает система разных по знаку, но одинаковых по величине электрических зарядов (d+ и d-) – электрический диполь (рис. 2.23).
|
Мерой полярности связи (характеристикой диполя) является дипольный момент m – произведение величины заряда d на расстояние между центрами тяжести положительных и отрицательных зарядов (длина диполя l).
Единицей измерения дипольного момента в системе СИ [КлЧм] чаще используется внесистемная единица Дебай (D): 1 D = 3,33Ч10-30 КлЧм.
В гетероядерных молекулах связь всегда полярна, но если число атомов в молекуле три и более, то возникающая при этом система распределения зарядов может привести к тому, что молекула в целом не будет являться диполем – центры тяжести положительных и отрицательных зарядов совпадают. Как правило, это связано с симметричным строением молекулы.
Если молекулу, даже если она не является диполем, поместить в электрическое поле напряженностью Е, происходит разделение центров тяжести зарядов в результате смещения электронов относительно ядер, и смещения атомов относительно друг друга в молекуле. При этом молекула приобретает наведенный (индуцированный) дипольный момент. Способность молекул приобретать в электрическом поле дипольный момент называется поляризуемостью.
Дипольный момент наведенного диполя пропорционален напряженности электрического поля: 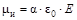 , где a– коэффициент поляризуемости (поляризуемость) атома или молекулы, e0 – электрическая постоянная.
, где a– коэффициент поляризуемости (поляризуемость) атома или молекулы, e0 – электрическая постоянная.
Пример.
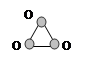 Молекула Молекула | Дипольный момент связи, D | Дипольный момент молекулы, D | Строение молекулы |
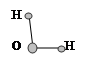 O3 O3 | |||
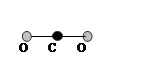 H2O H2O | 1,5 | 1,84 | |
| CO2 | 2,7 |
ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
И ЖИДКОСТЯХ
Агрегатные состояния
Вещества в зависимости от внешних условий (температура и давление) и их химического состава могут существовать в трех основных агрегатных состояниях: газообразном, жидком и твердом. При достаточно низких температурах вещества находятся в твердом состоянии, а при относительно высоких – в жидком и газообразном.
При нагревании происходит, как правило, последовательный переход веществ из твердого в жидкое и газообразное состояние (плавление и испарение), а при охлаждении протекают обратные процессы (конденсация и кристаллизация). Эти переходы осуществляются при определенной температуре (температуре фазового перехода), при этом скачкообразно изменяется молярный объем вещества и энтропия (энергетическая характеристика степени разупорядоченности системы), поглощается или выделяется тепловая энергия (энтальпия фазового перехода). Температура перехода из одного состояния в другое зависит от химической природы вещества и давления. Конкретные значения температур фазовых переходов для различных веществ лежат в широких пределах (табл. 3.1). Необходимо отметить, что при определенных условиях возможен фазовый переход твердое состояние – газ (сублимация-кристаллизация).
Таблица 3.1
Температуры (°С), энтальпия (DН0, кДж/моль) и энтропии (DS0, Дж/моль×К) фазовых переходов некоторых веществ при атмосферном давлении
| Вещество | Тип кристалла | Фазовый переход | |||||
| Плавление - кристаллизация | Кипение – конденсация | ||||||
| tпл, °С | DН0пл, | DS0 пл, | tкип, °С | DН0исп, | D S0исп, | ||
| N2 | Молекулярный | -210 | 0,721 | 11,4 | -195,8 | 5,59 | 72,4 |
| CH4 | -//- | -182,5 | 0,938 | 10,4 | -164 | 8,18 | 75,0 |
| H2O | -//- | 6,013 | 22,0 | 40,683 | 109,07 | ||
| C6Н6 | -//- | 5,5 | 9,837 | 35,3 | 80,1 | 30,76 | 87,1 |
| S(b) | -//- | 119,3 | 1,72 | 4,4 | 9,2 | 12,8 | |
| Si | Ковалентный | 49,8 | 29,5 | 99,6 | |||
| AgCl | Ионный | 13,2 | 18,1 | 100,5 | |||
| NaCl | -//- | 28,2 | 26,3 | 78,3 | |||
| MgF2 | -//- | 37,8 | 107,7 | ||||
| Na | Металлический | 97,9 | 2,60 | 7,01 | 90.1 | 77,7 | |
| Ag | -//- | 960,5 | 11,3 | 9,2 | 102,9 | ||
| W | -//- | 35,1 | 9,5 | 129,3 |
Жидкое и твердое агрегатные состояния относят к конденсированному состоянию вещества. Оно отличается от газообразного тем, что энергия взаимодействия между частицами, образующими вещество, сравнима по величине или превышает энергию их теплового движения. Это приводит к тому, что среднее расстояние между частицами (между центрами частиц) в газе при нормальных условиях составляет величину ~ 10 их диаметров, тогда как в конденсированном состоянии оно сравнимо с их диаметром. Молярный объем любого газа при нормальных условиях равен 22,4 л/моль, тогда как молярные объемы твердых веществ и жидкостей примерно в 103 раз меньше (0,01–0,05 л/моль).
Пример. Расчет средних размеров пространства, занимаемого одной частицей при атмосферном давлении.
|
 |
Газ. 1 моль газа при нормальных условиях занимает объем Vn = 22,4 л/моль и содержит 6,02×1023 молекул (число Авогадро).
Средний размер пространства, занимаемого одной частицей:
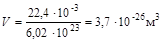 ,
, 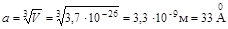 .
.
Размер молекулы азота (две длины связи) d N2 ~3 Ǻ.
Жидкость. 1 моль жидкого брома (Br2) занимает объем 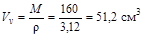 . М=160 г/моль – молярная масса брома, r=3,12 г/см3 – плотность жидкого брома, Vn – молярный объем жидкого брома.
. М=160 г/моль – молярная масса брома, r=3,12 г/см3 – плотность жидкого брома, Vn – молярный объем жидкого брома.
Средний размер пространства, занимаемого одной частицей:
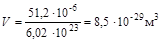 ,
, 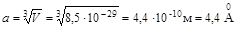 .
.
Размер молекулы брома (две длины связи) d Br2 ~ 4,56 Ǻ.
Кристалл. 1 моль металлического серебра занимает объем
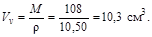
М=108 г/моль – молярная масса серебра, r=10,50 г/см3 – плотность серебра, Vn – молярный объем серебра.
Средний размер пространства, занимаемого одной частицей:
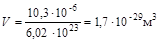 ,
, 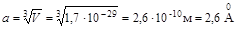 .
.
Размер атома серебра (два металлических радиуса) d Ag ~ 2,68 Ǻ.
В газах частицы находятся в броуновском движении, при этом отсутствуют ближний и дальний порядок в положении частиц. Газ не имеет собственного объема и, соответственно, формы. В жидкостях броуновское движение осложнено наличием более или менее устойчивого ближнего порядка в положении частиц относительно друг друга за счет возникновения химических связей между отдельными частицами. Жидкость имеет собственный объем, но из-за слабого межмолекулярного взаимодействия под действием силы тяжести принимает форму сосуда, в котором она находится. В твердом состоянии вещества энергия взаимодействия между частицами намного превышает энергию теплового движения, что приводит к фиксированию положений частиц в пространстве, вокруг которых они совершают колебательные и вращательные движения. Это определяет наличие у твердых тел собственной формы и объема и большое сопротивление сдвигу.
Сравнение энергетических характеристик фазовых переходов свидетельствует о существенно меньшей перестройке вещества при плавлении, чем при испарении. Как видно из табл. 3.1, для всех кристаллов с различным типом химической связи теплота (энтальпия) плавления много меньше теплоты испарения. Энтропия фазового перехода, характеризующая изменение степени упорядоченности системы, также для плавления много меньше, чем для испарения.
В газообразном состоянии, где присутствуют слабо или совсем не взаимодействующие между собой молекулы вещества, химическая связь внутри них рассматривается с использованием моделей «классической» ковалентной связи.
При рассмотрении конденсированного состояния вещества химическая связь описывается с использованием моделей ковалентной, ионной и металлической связи. При этом необходимо принимать во внимание близкое расположение частиц, образующих систему. Это обстоятельство в ряде случаев (жидкости, молекулярные кристаллы) обусловливает необходимость учитывать существенный вклад межмолекулярного взаимодействия в энергию химических связей.
Необходимо отметить, что целый ряд веществ может не иметь одного из агрегатных состояний. Чаще всего это относится к жидкому и газообразному состояниям. Данное обстоятельство связано с соотношением между энергией, необходимой для перевода вещества из одного агрегатного состояния в другое, и энергией, достаточной для разрыва внутримолекулярных химических связей. Например, во многих нерастворимых в воде гидроксидах металлов при нагревании раньше протекает реакция дегидратации (Cu(OH)2® CuO + H2O), а затем происходит плавление вещества.
