Количественные характеристики химической связи: энергия связи, длина, валентный угол. Полярность связи и полярность молекулы в целом, дипольный момент молекулы.
1. Энергия химической связи является мерой ее прочности.
Энергия связи — это энергия, выделяющаяся при образовании одного моля связей данного типа или энергия, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества (количество связей равное числу Авогадро). Чаще всего энергию связи измеряют в кДж/моль. Наиболее прочными являются ионные и ковалентные связи, энергии этих связей составляют величины от десятков до сотен кДж/моль. Металлическая связь, как правило, несколько слабее ионных и ковалентных связей, но величины энергий связи в металлах близки к значениям энергии ионных и ковалентных связей. Об этом свидетельствуют, в частности, высокие температуры кипения металлов, например 357 °С (Hg), 880 °С (Na), 3000 ° С (Fe) и т. д. Так например, при образовании одного моля молекул водорода из атомов выделяется 435 кДж/ моль энергии. Такова энергия связи Н – Н. Такое же количество энергии необходимо затратить для того, чтобы превратить один моль молекул в атомы: Н2 = 2Н – 435 кДж/моль.
2. Длина связи – расстояние между ядрами связанных атомов. Так в молекуле воды длина связей между атомом кислорода и атомами водорода составляет 0,096 нм (d (OH) = 0,096 нм), в молекуле аммиака длина связи между атомом азота и атомами водорода составляет 0,1015 нм.
3. Валентный угол или угол связи – угол между линиями двух связей одного и того же атома. Очевидно, что понятие валентного угла применимо только к молекулам (ионам, радикалам), содержащим три и более атомов в молекуле (ионе, радикале). Так, в молекуле воды угол связи составляет 104,50, в молекуле аммиака – 107,30:

Ковалентная связь характеризуется направленностью и насыщаемостью. Ионная и металлическая связи не имеют определенной направленности.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможную валентность элемента. Число уже использованных для этого орбиталей определяет валентность элемента в данном соединении.
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной.
4. Ковалентная связь может быть полярной или неполярной.
Неполярной является связь, образованная атомами одного и того же элемента. При этом общее электронное облако расположено симметрично в пространстве между ядрами. Полярная связь образуется между атомами разных элементов.
Полярность связи количественно оценивается дипольным моментом µ, который является произведением длины диполя l — расстояния между двумя равными по величине и противоположными по знаку зарядами +q и -q — на абсолютную величину заряда: µ = l × q.
Дипольный момент является величиной векторной и направлен по оси диполя от отрицательного заряда к положительному.
В системе СИ дипольный момент измеряется в Кл×м, но обычно для полярных молекул в качестве единицы измерения используется дебай (единица названа в честь П. Дебая):
1 D = 3,33×10–30 Кл×м
Следует различать дипольные моменты (полярность) связи и молекулы в целом. Так, для простейших двухатомных молекул дипольный момент связи равен дипольному моменту молекулы.
Для многоатомных молекул дипольный момент представляет собой векторную сумму дипольных моментов химических связей. Поэтому, если молекула симметрична, то она может быть неполярной, даже если каждая из ее связей обладает значительным дипольным моментом. Например, в плоской молекуле BF3 или в линейной молекуле BeCl2 сумма дипольных моментов связей равна нулю:

Аналогично, нулевой дипольный момент имеют тетраэдрические молекулы CH4 и CBr4. Однако, нарушение симметрии, например в молекуле BF2Cl, обусловливает дипольный момент, отличный от нуля.
B молекуле оксида углерода (IV) каждая из связей полярна, а молекула в целом неполярна (µ = 0), так как молекула О==С==О линейна, и дипольные моменты связей С==О компенсируют друг друга. Наличие дипольного момента в молекуле воды означает, что она нелинейна, т. е. связи О—Н расположены под углом, не равным 180° (104,50 ).
О==С==О
µ→ ←µ
Квантовомеханическая трактовка механизма образования ковалентной связи в молекуле водорода.
Разработка квантовой механики и использование многих экспериментальных методов (молекулярной спектроскопии, рентгенографии кристаллов, газовой электронографии, методов изучения магнитных свойств) для определения длин связей (межатомных расстояний), углов между связями, числа неспаренных электронов и других структурных параметров молекул и кристаллов привели к более глубокому пониманию природы химической связи.
Ковалентная связь. В 1927 датский физик О. Бурро выполнил квантовомеханический расчёт молекулярного нона водорода и показал, что единственный электрон в этом ионе занимает орбиталь, называемую молекулярной орбиталью, которая простирается вокруг обоих протонов. Теоретический расчёт энергии связи этого молекулярного иона, т. е. разности между суммарной энергией отдельного атома и протона и энергией иона в его основном состоянии, привёл к значению 255 кдж×моль-1, прекрасно согласующемуся с экспериментом. Вскоре было отмечено, что электронную структуру молекулярного иона водорода можно рассмотреть, используя волновую функцию основного состояния атома водорода. По мере сближения атома водорода и протона появляется возможность выхода электрона из области, окружающей одно ядро, в область, окружающую второе ядро, причём в каждом случае электрон занимает 1s-орбиталь. Молекулярная орбиталь, образованная как сумма этих двух 1s-орбиталей, является хорошим приближением к молекулярной орбитали, полученной Бурро путём решения волнового уравнения Шрёдингера. Если образовать волновую функцию как разность двух 1s-орбиталей, то это, как было показано, отвечает не притяжению, а отталкиванию. Первая 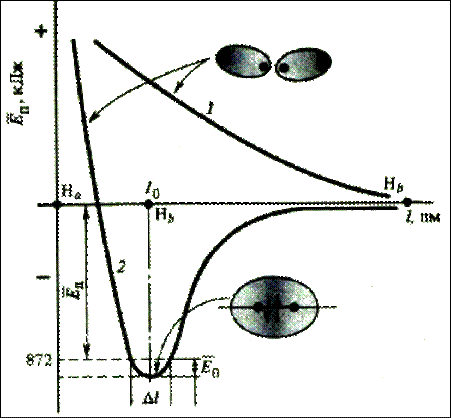 волновая функция является симметричной линейной комбинацией двух 1s-функций и отвечает устойчивому состоянию, образованию одноэлектронной ковалентной связи, тогда как вторая функция, являющаяся антисимметричной линейной комбинацией тех же 1s-функций, отвечает неустойчивому состоянию. Иногда говорят, что образование одноэлектронной ковалентной связи в молекуле водорода соответствует резонансу данного электрона между двумя атомными орбиталями или между двумя атомами водорода.
волновая функция является симметричной линейной комбинацией двух 1s-функций и отвечает устойчивому состоянию, образованию одноэлектронной ковалентной связи, тогда как вторая функция, являющаяся антисимметричной линейной комбинацией тех же 1s-функций, отвечает неустойчивому состоянию. Иногда говорят, что образование одноэлектронной ковалентной связи в молекуле водорода соответствует резонансу данного электрона между двумя атомными орбиталями или между двумя атомами водорода.
В том же году (1927) было выполнено два квантовомеханических расчёта химической связи в молекуле водорода. Американский физик Э. У. Кондон использовал метод молекулярных орбиталей, приписав молекуле водорода структуру, в которой за основу была принята орбиталь H2+, рассчитанная Бурро, причём к этой орбитали были отнесены оба электрона с противоположными спинами. В 1927 г. Гайтлером и Лондоном был выполнен теоретический расчет энергии двух атомов водорода в зависимости от расстояния между ними. Оказалось, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы. При противоположно направленных спинах на энергетической кривой имеется минимум, т.е. образуется устойчивая система – молекула водорода Н2. В. Гейтлер и Ф. Лондон отнесли один электрон, с положительным спином, к 1s-орбитали одного атома водорода, а второй, с отрицательным спином, к 1s-орбитали др. атома водорода. Волновая функция для данной молекулы была суммой этой функции и функции, в которой два электрона менялись местами - электрон с положительным спином относился ко второму атому, а с отрицательным - к первому атому. Оба расчёта, как Кондона, так и Гейтлера и Лондона, привели к выводу об устойчивости молекулы водорода с энергией связи, превышающей приблизительно в 1,7 раза энергию связи в молекулярном ионе водорода. Связь между двумя атомами водорода в молекуле водорода - прототип связи с поделенной электронной парой по Льюису, обычно называют ковалентной связью.
На основании формальных результатов квантовомеханического рассмотрения химической связи можно сделать следующий простой вывод: атомы могут образовывать ковалентную связь (осуществляемую парой электронов) за счёт каждой стабильной орбитали, занятой первоначально одним электроном; при этом образуется связь такого типа, как описанная выше для молекулы водорода, а её стабильность может быть связана с тем же самым явлением резонанса. Иными словами, для образования ковалентной связи необходимо наличие двух электронов с противоположными спинами и по одной стабильной орбитали у каждого из двух связываемых атомов.
Атом водорода с единственной стабильной орбиталью (1s) может образовывать лишь одну ковалентную связь. Атом углерода и другие атомы второго периода (бор, азот, кислород) могут образовывать не более четырёх ковалентных связей с использованием четырёх орбиталей L-оболочки. Квантовомеханическое рассмотрение приводит также к выводу, что каждая дополнительная связь, образующаяся в молекуле, в общем случае ведёт к дальнейшей стабилизации молекулы, а следовательно, наиболее устойчивы такие электронные структуры молекулы, в которых все стабильные орбитали атомов либо использованы для образования связей, либо заполнены неподелёнными парами электронов.
Ковалентная связь. Основные положения метода валентных связей. Спиновая теория валентности. Обменный и донорно-акцепторный механизм образования ковалентной связи.
Образование ковалентной связи можно рассматривать в рамках двух методов квантовой химии: метода валентных связей и метода молекулярных орбиталей.
В 1916 г. американский ученый Льюис высказал предположение о том, что химическая связь образуется за счет обобществления двух электронов. При этом электронная оболочка атома стремится по строению к электронной оболочке благородного газа. В дальнейшем эти предположения послужили основой для развития метода валентных связей. Образование химической связи между атомами водорода является результатом взаимопроникновения (перекрывания) электронных облаков. Вследствие этого перекрывания плотность отрицательного заряда в межъядерном пространстве возрастает, и положительно заряженные ядра притягиваются к этой области. Такая химическая связь называется ковалентной.
Представления о механизме образования молекулы водорода были распространены на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения:
1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам и находится на орбитали, образовавшейся за счет перекрывания двух атомных орбиталей.
2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные
облака. Связь образуется в том случае, когда в атомные волновые функции образующие связь будут иметь одинаковые знаки в области перекрывания.
3) Химическая связь в методе ВС является двухцентровой и локализована в области между ядрами двух атомов ее образующих.
Метод валентных связей (ВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности. B образовании химической связи принимают участие валентные электроны.
Валентность атома в данном соединении – это количество общих электронных пар, которые данный атом образует с другими атомами. Например, валентность азота в аммиаке (NH3) равна трем, а в ионе аммония (NH4+) – четырем.
Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
Способы образования ковалентной связи: Существуют два главных способа образования ковалентной связи .
1) Электронная пара, образующая связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденных атомах.
Однако число ковалентных связей может быть больше числа неспаренных электронов. Например, в невозбужденном состоянии (которое называется также основным состоянием) атом углерода имеет два неспаренных электрона, однако для него характерны соединения, в которых он образует четыре ковалентные связи. Это оказывается возможным в результате возбуждения атома. При этом один из s-электронов переходит на p-подуровень и в атоме углерода появлется вместо двух (основное состояние) четыре неспаренных электрона: С 1s22s22p2 → C* 1s22s12p3
Увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на возбуждение атома. Поскольку валентность атома зависит от числа неспаренных электронов, возбуждение приводит к повышению валентности. У атомов азота, кислорода, фтора количество неспаренных электронов не увеличивается, т.к. в пределах второго уровня нет свободных орбиталей, а перемещение электронов на третий квантовый уровень требует значительно большей энергии, чем та, которая выделилась бы при образовании дополнительных связей. Таким образом, при возбуждении атома переходы электронов на свободные орбитали возможны только в пределах одного энергетического уровня.
Элементы 3-го периода – фосфор, сера, хлор – могут проявлять валентность, равную номеру группы. Это достигается возбуждением атомов с переходом 3s- и 3p-электронов на вакантные орбитали 3d-подуровня:
P* 1s22s22p63s13p33d1 (валентность 5)
S* 1s22s22p63s13p33d2 (валентность 6)
Cl* 1s22s22p63s13p33d3 (валентность 7)
В приведенных выше электронных формулах возбужденных атомов подчеркнуты подуровни, содержащие только неспаренные электроны. На примере атома хлора легко показать, что валентность может быть переменной:
Cl 1s22s22p63s23p5 (валентность 1) → Cl* 1s22s22p63s23p43d1 (валентность 3) →
Cl* 1s22s22p63s23p33d2 (валентность 5) → Cl*1s22s22p63s13p33d3 (валентность 7)
В отличие от хлора, валентность атома F постоянна и равна 1, т.к. на валентном (втором) энергетическом уровне отсутствуют орбитали d-подуровня и другие вакантные орбитали.
Различают два механизма образования ковалентной связи – обменный и донорно-акцепторный.
Обменный возникает посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону в обобществленную электронную пару. Это наиболее типичный механизм образования ковалентной связи (например в молекулах: HBr, HCl, H2, N2, и.т.д.).
Донорно-акцепторный механизм заключается в том, что ковалентная связь образуется в результате перехода уже существующей электронной пары донора (поставщика электронов) в общее пользование донора и акцептора. Донорно-акцепторный механизм хорошо иллюстрируется схемой образования иона аммония: NH3 + H+ = NH4+
В молекуле аммиака три ковалентные связи образованы по обменному механизму, так как у атома азота имелись три неспаренных электрона, а у атомов водорода по одному. В тоже время у атома азота на внешнем энергетическом уровне было пять электронов и после образования молекулы аммиака осталась одна неподеленная пара электронов. В катионе водорода (протоне) отсутствует электронная оболочка, а значит остается свободной орбиталь. Таким образом, атом азота в аммиаке является донором электронной пары, а протон – ее акцептором при образовании иона аммония.
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Важно отметить, что связи Н—N, образованные по различным механизмам, никаких различий в свойствах не имеют, т. е. все связи равноценны, независимо от механизма их образования. Указанное явление обусловлено тем, что в момент образования связи орбитали 2s- и 2р-электронов атома азота изменяют свою форму. В итоге возникают четыре совершенно одинаковые по форме орбитали (здесь осуществляется sp3-гибридизация).
В качестве доноров обычно выступают атомы с большим количеством электронов, но имеющие небольшое число неспаренных электронов. Для элементов II периода такая возможность кроме атома азота имеется у кислорода (две неподеленные пары) и у фтора (три неподеленные пары). Например, ион водорода Н+ в водных растворах никогда не бывает в свободном состоянии, так как из молекул воды Н2О и иона Н+ всегда образуется ион гидро-ксония Н3О+ Ион гидроксония присутствует во всех водных растворах, хотя для простоты в написании сохраняется символ H+.
Донорно-акцепторный механизм образования связи помогает понять причину амфотерности гидроксида алюминия в молекулах Аl(ОН)3 вокруг атома алюминия имеется 6 электронов — незаполненная электронная оболочка. Для завершения этой оболочки не хватает двух электронов. И когда к гидроксиду алюминия прибавляют раствор щелочи, содержащей большое количество гидроксильных ионов, каждый из которых имеет отрицательный заряд и три неподеленные пары электронов (ОН)-, то ионы гидроксида атакуют атом алюминия и образуют ион [Аl(ОН)4]-, который имеет отрицательный заряд (переданный ему гидроксид-ионом) и полностью завершенную восьмиэлектронную оболочку вокруг атома алюминия.
Аналогично происходит образование связей и во многих других молекулах, даже в таких “простых”, как молекула НNО3:
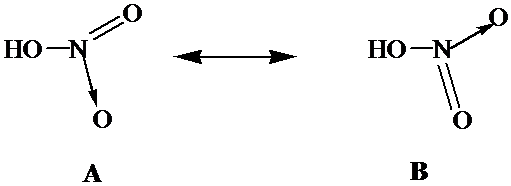
Атом азота при этом отдает свою электронную пару атому кислорода, который ее принимает: в результате как вокруг атома кислорода, так и вокруг азота достигается полностью завершенная восьмиэлектронная оболочка, но поскольку атом азота отдал свою пару и поэтому владеет ею совместно с другим атомом, он приобрел заряд “+”, а атом кислорода — заряд “-”. Cтепень окисления азота в HNO3 равна 5+, тогда как валентность равна 4.
