Сольватация (гидратация). Электролитическая диссоциация
Взаимодействие растворенных частиц с молекулами растворителя называется сольватацией (для водных растворов - гидратацией). Молекулярные группы, образующиеся в результате сольватации, носят название сольватов.
Электрический ток представляет собою направленное движение носителей электричества - электронов (в металлах) или ионов (в растворах). Проводники, обладающие электронной проводимостью называют проводниками первого рода, а ионной проводимостью - проводниками второго рода. К проводникам первого рода относятся, например, металлы, а к проводникам второго рода - растворы и расплавы.
Электролитами называют вещества, которые в растворе или в расплаве распадаются на положительные и отрицательно заряженные частицы ионы. Этот процесс называется электролитической диссоциацией.
Способность к электролитической диссоциации обнаруживают вещества, образующие кристаллы или состоящие из молекул с высокополярной ковалентной связью, при растворении их в растворителях с высокой диэлектрической проницаемостью[1]. При переносе ионного кристалла из воздуха  в растворитель, например, в воду
в растворитель, например, в воду  I, силы притяжения между ионами уменьшаются в 81 раз и кристаллическая решетка распадается на ионы. Если же растворяемое вещество состоит из молекул с полярной ковалентной связью, то поляризация его молекул и распад их на ионы происходит в результате диполь-дипольного взаимодействия с полярными молекулами растворителя, а иногда и в результате образования между молекулами растворителя и растворенного вещества водородных или донорно-акцепторных связей.
I, силы притяжения между ионами уменьшаются в 81 раз и кристаллическая решетка распадается на ионы. Если же растворяемое вещество состоит из молекул с полярной ковалентной связью, то поляризация его молекул и распад их на ионы происходит в результате диполь-дипольного взаимодействия с полярными молекулами растворителя, а иногда и в результате образования между молекулами растворителя и растворенного вещества водородных или донорно-акцепторных связей.
Под действием электрического поля иона полярные молекулы растворителя ориентируются соответствующим образом, создавая вокруг каждого иона сольватную оболочку, в которую входит определенное число молекул растворителя, прочно связанных с ионом и участвующих в тепловом движении вместе с ним как единое целое. Энергия ион-дипольных взаимодействий довольно велика (соизмерима с энергией химических связей): она тем больше, чем больше заряд[2] и меньше радиус иона. Наличие вокруг иона сольватной оболочки и высокая диэлектрическая проницаемость растворителя препятствует рекомбинации (объединению в молекулу) ионов.
В зависимости от способности веществ к диссоциации, их условно делят на сильные электролиты, в которых растворенное вещество полностью распадаются на ионы, слабые электролиты в которых диссоциация происходит частично, и неэлектролиты, не диссоциирующие на ионы.
Поскольку способность веществ диссоциировать на ионы зависит от свойств растворителя, то одно и то же вещество в одном растворителе может быть сильным электролитом, а в другом - слабым, или неэлектролитом.
Для водных растворов к сильным электролитам относят почти все неорганические соли, (за исключением некоторых солей кадмия и ртути), такие кислоты как 








 и гидроксиды щелочных и щелочно - земельных металлов. Чем меньше сила притяжения водорода к кислотному остатку, тем сильнее электролит. Например, в ряду HF – HCl – HBr – Hl радиус иона галогена увеличивается, сила взаимодействия с ионом водорода уменьшается и диссоциация кислоты возрастает от HF
и гидроксиды щелочных и щелочно - земельных металлов. Чем меньше сила притяжения водорода к кислотному остатку, тем сильнее электролит. Например, в ряду HF – HCl – HBr – Hl радиус иона галогена увеличивается, сила взаимодействия с ионом водорода уменьшается и диссоциация кислоты возрастает от HF 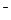 к Hl
к Hl 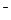 . В ряду
. В ряду  увеличивается число атомов кислорода, оттягивающих на себя электронную плотность, что приводит к уменьшению силы взаимодействия водород - кислород, в результате чего диссоциация кислоты возрастает от
увеличивается число атомов кислорода, оттягивающих на себя электронную плотность, что приводит к уменьшению силы взаимодействия водород - кислород, в результате чего диссоциация кислоты возрастает от  к
к  . В ряду
. В ряду  при одинаковом числе атомов кислорода неметаллические свойства центрального атома наиболее ярко выражены у серы и поэтому серная кислота диссоциирует полностью, а теллуровая кислота является слабо диссоциирующей.
при одинаковом числе атомов кислорода неметаллические свойства центрального атома наиболее ярко выражены у серы и поэтому серная кислота диссоциирует полностью, а теллуровая кислота является слабо диссоциирующей.
К слабым электролитам, в водных растворах, относятся многие органические кислоты например:  , некоторые неорганические кислоты
, некоторые неорганические кислоты  и большинство оснований
и большинство оснований  . Вода относится к слабым электролитам и диссоциирует на ион гидроксония
. Вода относится к слабым электролитам и диссоциирует на ион гидроксония  и гидро-ксид – иона
и гидро-ксид – иона  по реакции:
по реакции:

Уравнение диссоциации воды в дальнейшем мы будем записывать в краткой форме:
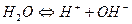
и называть концентрацию и активность ионов гидроксония концентрацией и активностью водородных ионов.
К неэлектролитам относится большинство органических растворов.
Закон электронейтральности
При диссоциации молекул, число положительных и отрицательных ионов определяется стехиометрическими индексами в формуле молекулы. Электролиты, в которых ионы обладают одинаковым зарядом катиона и аниона, например, 1-1-электролит KCl 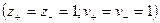 или 2-2-электролит
или 2-2-электролит 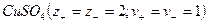 , распадаются на два иона - называются симметричные или симметричными. Электролиты, в которых ионы обладают неодинаковым зарядом катиона и аниона, например, 1-2-электролит
, распадаются на два иона - называются симметричные или симметричными. Электролиты, в которых ионы обладают неодинаковым зарядом катиона и аниона, например, 1-2-электролит 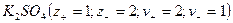 или 3-1–электролит
или 3-1–электролит 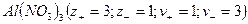 , называются несимметричными. Для любого типа электролита в элементарном объеме сумма зарядов анионов и катионов всегда одинакова (закон электронейтральности) :
, называются несимметричными. Для любого типа электролита в элементарном объеме сумма зарядов анионов и катионов всегда одинакова (закон электронейтральности) :
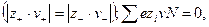 (32.1)
(32.1)
Где 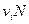 число частиц в растворе.
число частиц в растворе.
