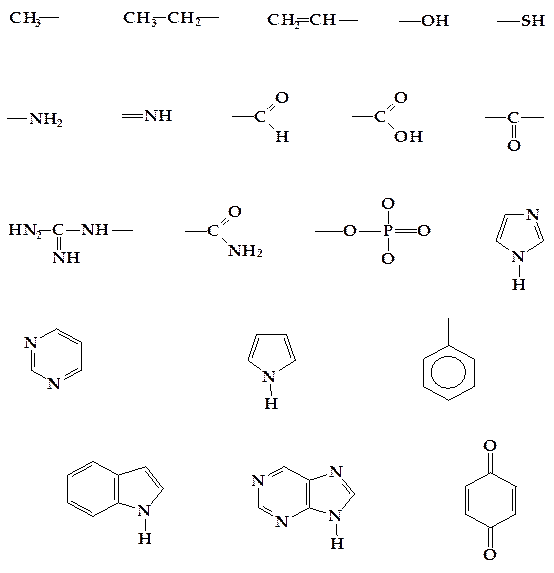ГЛАВА 1. ЭЛЕМЕНТАРНЫЙ И МОЛЕКУЛЯРНЫЙ СОСТАВЫ ЖИВОГО
В природе встречается около 80 стабильных химических элементов, однако их них только 15 элементов входят в состав живой материи и еще 8-10 обнаружены только в определенных организмах.
Химические организмы почти на 99 % состоят из четырех химических элементов: водорода (Н) (2-3 % сухого вещества), кислорода (О) (25-30 %), углерода (С) (50-60 %) и азота (N) (8-10 %). Водород и кислород – составные элементы воды, на которую приходится до 60-70 % массы клеток. Многие биомолекулы содержат также атомы серы (S) и фофсора (Р). Перечисленные макроэлементы входят в состав всех живых организмов.
Химические элементы, относящиеся ко второй важной в биологическом отношении группе и в сумме составляющие примерно 0,5% массы тела животного и человека, присутствуют, за немногими исключениями, в виде ионов. Эта группа включает щелочные металлы (натрий (Na) и калий (К)), щелочноземельные металлы (магний (Мg) и кальций (Са)), галогены (хлор (CI)). Другие жизненно важные (эссенциальные) химические элементы присутствуют в столь малых количествах, что их называют следовыми элементами. Эта группа включает переходные металлы: железо (Fe), цинк (Zn), медь (Сu), кобальт (Со) и марганец (Мn). К жизненно важным микроэлементам относятся также некоторые неметаллы, такие, как иод (I) и селен (Se).
Малые размеры атомов водорода, кислорода, углерода и азота обуславливают их особое отличительное свойство, а именно – способность образовывать короткие, прочные химические связи. Молекулы с такими связями более устойчивы к действию химических и физических факторов. Кроме того, большое значение имеет также способность перечисленных элементов образовывать кратные связи (двойные, реже тройные).
Ковалентные связи, обладающие энергией от 50 до 300 кДж/моль, являются основными в биомолекулах, и определяют особенности их строения.
Ионные связи («солевые мостики»), несмотря на небольшие значения энергии (в среднем около 4-5 кДж/моль) важны для поддержания структуры многих биомолекул и для протекания биохимических реакций.
Водородные связи возникают в результате дипольных взаимодействий, особенно между атомами водорода и кислорода или водорода и азота, что объясняется достаточно высокой элеткроотрицательностью этих элементов и малым объемом атома водорода. Величина энергии водородной связи ~13 кДж/моль.
Гидрофобные связи, или точнее взаимодействия, возникают между неполярными частями одной или нескольких молекул. Энергия таких связей невелика и колеблется в пределах от 4 до 8 кДж/моль. Несмотря на низкий энергетический запас такие связи очень важны в поддержании конформации биомолекул и структур надмолекулярных комплексов.
Биомолекулы отличаются сложным составом и содержат разнообразные структуры. Среди многочисленных функциональных групп в биомолекулах важнейшими являются группы наглядно изображенные на рисунке 1.1.
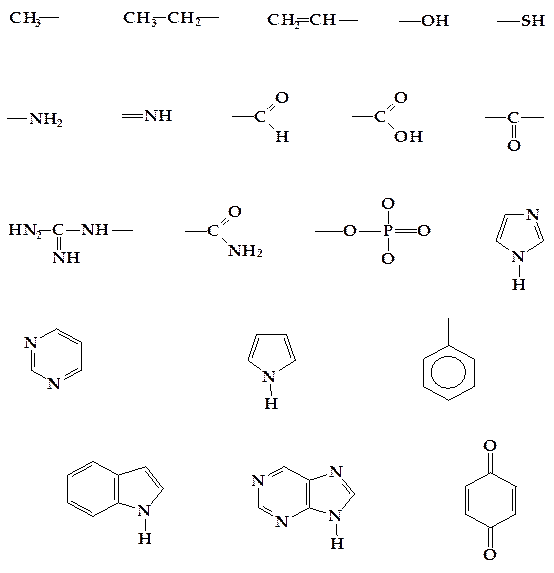
Рисунок 1.1 - Важнейшие функциональные группы и гетероциклы
Условно все молукулы клетки можно разделить на: малые органические молекулы с молекулярной массой до 1 кДа и макромолекулы, или высокомолекулярные, молекулярная масса которых варьирует в пределах от 1 до 1000 кДа.
К малым органическим молекулам условно относят: аминокислоты, сахара (моносахариды и олигосахара), нуклеотиды и жирные (карбоновые) кислоты. К макромолекулам относятся: белки, полисахариды (гомо- и гетерополисахариды), нуклеиновые кислоты, липиды.
Свыше 90 % всей массы клеток приходится на долю воды. В ней растворены многие биологические вещества, активность которых будет определяться свойствами воды как универсального растворителя.
Необходимо также отметить уникальные свойства воды, имеющие огромную роль в протекании всех биохимических реакций:
¾ вода – универсальный растворитель;
¾ у воды низкая температура замерзания и высокая температура кипения;
¾ диэлектрическая проницаемость воды, равная 80, дает возможность удерживать растворенные в ней вещества на расстоянии, способствуя образованию диполей;
¾ высокая теплота испарения (~540 кал/г) и высокая теплоемкость, равная 1 кал для нагрева 1 г воды на 1 градус, позволяет поддерживать постоянной температуру живых существ;
¾ плотность воды максимальна при 4 0С и выше, она превышает плотность льда, что позволяет сохранять жизнь от замерзания;
¾ водородные связи, образующиеся между молекулами воды, важны для поддержания структуры макромолекул и их функционирования.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Дайте определение ковалентным связям. Опишите характер данных связей.
2. Какие химические элементы, присутствующие в биомолекулах, можно отнести к эссенциальным?
3. Перечислите макроэлементы, входящие в состав всех живых организмов.
4. Какие молекулы клетки можно условно отнести к малым органическим молекулам?
5. Какова роль воды в жизнедеятельности клетки?