Химическое равновесие. Константа равновесия, ее зависимость от температуры. Возможность смещения равновесия химической реакции. Принцип Ле-Шателье.
В ходе самопроизвольного процесса энергия Гиббса уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Дальнейшее изменение энергии Гиббса при неизменных условиях становится невозможным, система переходит в состояние химического равновесия. При его наступлении она не может больше совершать полезную работу, поэтому термодинамическим критерием установления равновесия является следующее уравнение:
∆G = 0
Таким образом, любая химическая реакция протекает самопроизвольно только в направлении, приближающем систему к состоянию равновесия. Причем движущей силой данного процесса является изменение изобарно-изотермического потенциала системы ∆G. Чем ∆G меньше, тем дальше система находится от состояния равновесия и тем более она реакционноспособна
Равновесие может существовать только для обратимых реакций.
Если реакция осуществляется в газовой фазе, то установлено, что ∆G образования 1 моля газа при его равновесном парциальном давлении p(отличном от 1) равна
∆Gобр= ∆G°298∙RTlnp
Для реакций, протекающих в растворе, ∆G образования вещества рассчитывается аналогично:
∆Gобр= ∆G°298∙RTlnC
где C– равновесная молярная концентрация растворенного вещества
Отношение двух постоянных величин есть величина постоянная, и называется она константой химического равновесия:
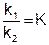 (6.5)
(6.5)
Константа равновесия показывает во сколько раз скорость прямой реакции больше или меньше скорости обратной реакции.
Константа равновесия – это отношение произведения равновесных концентраций продуктов реакции, взятых в степени их стехиометрических коэффициентов к произведению равновесных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов.
Принцип Ле Шателье: Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия, то в системе усилится то направление процесса, которое ослабляет это воздействие.
24. Реакции без участия и с участием электронов. Ионно-обменные и окислительно-восстановительные реакции.
Ионные реакции – это химические процессы, которые протекают в водном растворе с участием ионов электролитов.
Такие реакции могут протекать как с изменением так и без изменения степени окисления:
3Cu0 + 8HN +5O3 (разб.) = 3Сu +2(NO3)2 + 2N +2O| +4H2O
3Cu0 + 8H + +2NO3 - = 3Сu2+ + 2NO| +4H2O
NaOH + HCl = NaCl + H2O
H+ + OH- = H2O
В последнем случае реакции называются реакциями двойного обмена (или обменными реакциями)
Реакции обмена - реакции, происходящие между ионами - частицами, у которых все электроны спарены. Это реакции с ионным механизмом. Если ионы связываются в молекулы полярных соединений или в ионные кристаллы, то обратная реакция невозможна. Поэтому многие реакции ионного обмена необратимы, идут до конца.
Реакции в растворах электролитов идут, когда участвующие во взаимодействии ионы полностью или частично уходят из сферы реакции (в виде осадка, газа или слабого электролита). Сумма электрических зарядов левой части уравнения должна быть равна сумме электрических зарядов правой части.
Реакции, в результате которых изменяется степень окисления элементов, называются окислительно-восстановительными.
25. Окислительно-восстановительные реакции. Окислительные и восстановительные способности металлов, неметаллов и их ионов. Составление уравнений окислительно-восстановительных реакций методом электронно-ионного баланса.
1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность.
2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в ряду напряжений металлов после него. Исключениями являются лишь щелочные и щелочноземельные металлы, которые не будут восстанавливать ионы других металлов из растворов их солей. Это связано с тем, что в этих случаях с большей скоростью протекают реакции взаимодействия металлов с водой.
3. Все металлы, имеющие отрицательный стандартный электродный потенциал, т.е. находящиеся в ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот.
Метод электронного баланса основан на определении общего числа электронов, перемещавшихся от восстановителя к окислителю. Для составления уравнения окислительно-восстановительной реакции необходимо, прежде всего, знать химические формулы исходных веществ и получающихся продуктов. Исходные вещества нам известны, а продукты реакции устанавливаются либо экспериментально, либо на основании известных свойств элементов. Участие воды в реакции выясняется при составлении уравнения.
При составлении уравнения окислительно-восстановительной реакции необходимо соблюдать следующую логическую последовательность операций: рассмотрим реакцию взаимодействия Sb2S5и HNO3.
1. Устанавливаем формулы веществ, получающихся в результате реакции: Sb2S5+ HNO3= H3SbO4+NO+H2SO4.
2. Определяем степени окисления элементов, которые изменили ее в процессе реакции
Sb2S2-5 + HN5+O3 = H3SbO4+N2+O+H2S6+O4.
3.Определяем изменения, происшедшие в значениях степени окисления и устанавливаем окислитель и восстановитель.
В данной реакции степень окисления атомов серы S2-повысилась с 2- до 6+; следовательно, S2-является восстановителем. А степень окисления атомов азота N5+понизилась с 5+ до 2+; следовательно, N5+является окислителем. На основании этого составляем схему электронного баланса реакции:
N5+ + 3e N2+ ¦ 40 окислитель, процесс восстановления
S2-- 40e S6+¦ 3 восстановитель, процесс окисления
Пользуясь правилом электронного баланса, определяем общее число перемещающихся электронов нахождения наименьшего кратного. В данном случае оно равно 120.
4. Находим основные коэффициенты, то есть коэффициенты при окислителе и восстановителе
3 Sb2S5 + 40 HNO3 = H3SbO4 + NO + H2SO4.
5. Согласно закону сохранения массы расставляем коэффициенты в правой части уравнения (продукты реакции) перед окисленной и восстановленной формами:
3 Sb2S5 + 40 HNO3 = H3SbO4 + 40 NO + 15 H2SO4.
6. Проверяем число атомов каждого элемента (кроме водорода и кислорода) в исходных веществах и продуктах реакции и подводим баланс по этим элементам, расставляя коэффициенты:
3 Sb2S5 + 40 HNO3 = 6 H3SbO4 + 40 NO + 15 H2SO4.
7. Проверяем число атомов водорода в левой и правой частях уравнения и определяем число участвующих в реакции молекул воды
3 Sb2S5 + 40 HNO3 + 4 Н2О = H3SbO4 + 40 NO + 15 H2SO4.
8. Проверяем сумму атомов кислорода в левой и правой частях уравнения. Если баланс по кислороду сходится, то уравнение реак-ции составлено правильно.
Все вышеописанные операции производятся последовательно с одним и тем же уравнением и переписывать реакцию несколько раз не имеет смысла. Уравнение реакции окисления сульфида сурьмы азотной кислотой, с учетом схемы электронного баланса, запишется следующим образом:
3 Sb2S5 + 40 HNO3 + 4 Н2О = H3SbO4 + 40 NO + 15 H2SO4.
26. Способы выражения количественного состава раствора: массовая, молярная и нормальная концентрация, моляльность.
Массовая доля растворённого вещества (w) – это безразмерная физическая величина, равная отношению массы растворённого вещества к общей массе раствора,т.е.

Обычно выражается в долях единицы или в процентах. Массовая доля, выраженная в %, называется процентной концентрацией. Она показывает, какая масса вещества растворена в 100 г раствора.
Молярная концентрация (С) или молярность – это величина, равная отношению количества растворённого вещества к объему раствора (в литрах), т.е.
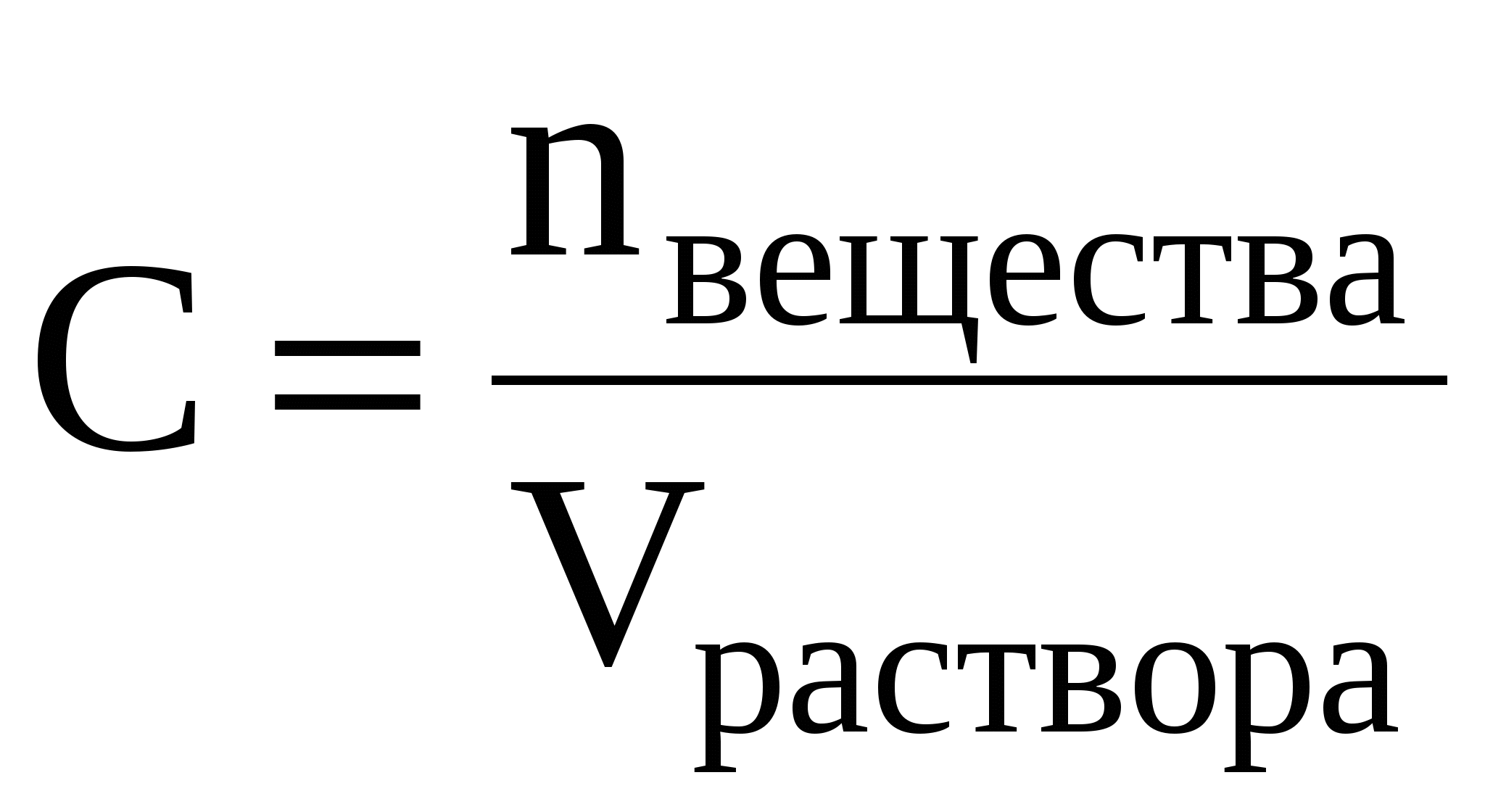
Молярность измеряется в моль/л и показывает, сколько моль вещества растворено в одном литре раствора. Молярность обозначается обычно буквой М. Если в одном литре раствора содержится 1 моль вещества, то такой раствор называется одномолярным(1М), если 0,1 моль вещества –децимолярным(0,1М), если 0,01 моль вещества –сантимолярным(0,01М), если 0,001 моль вещества –миллимолярным(0,001М).
Титром (Т) называется отношение массы вещества в граммах к объёму раствора в мл, т.е.
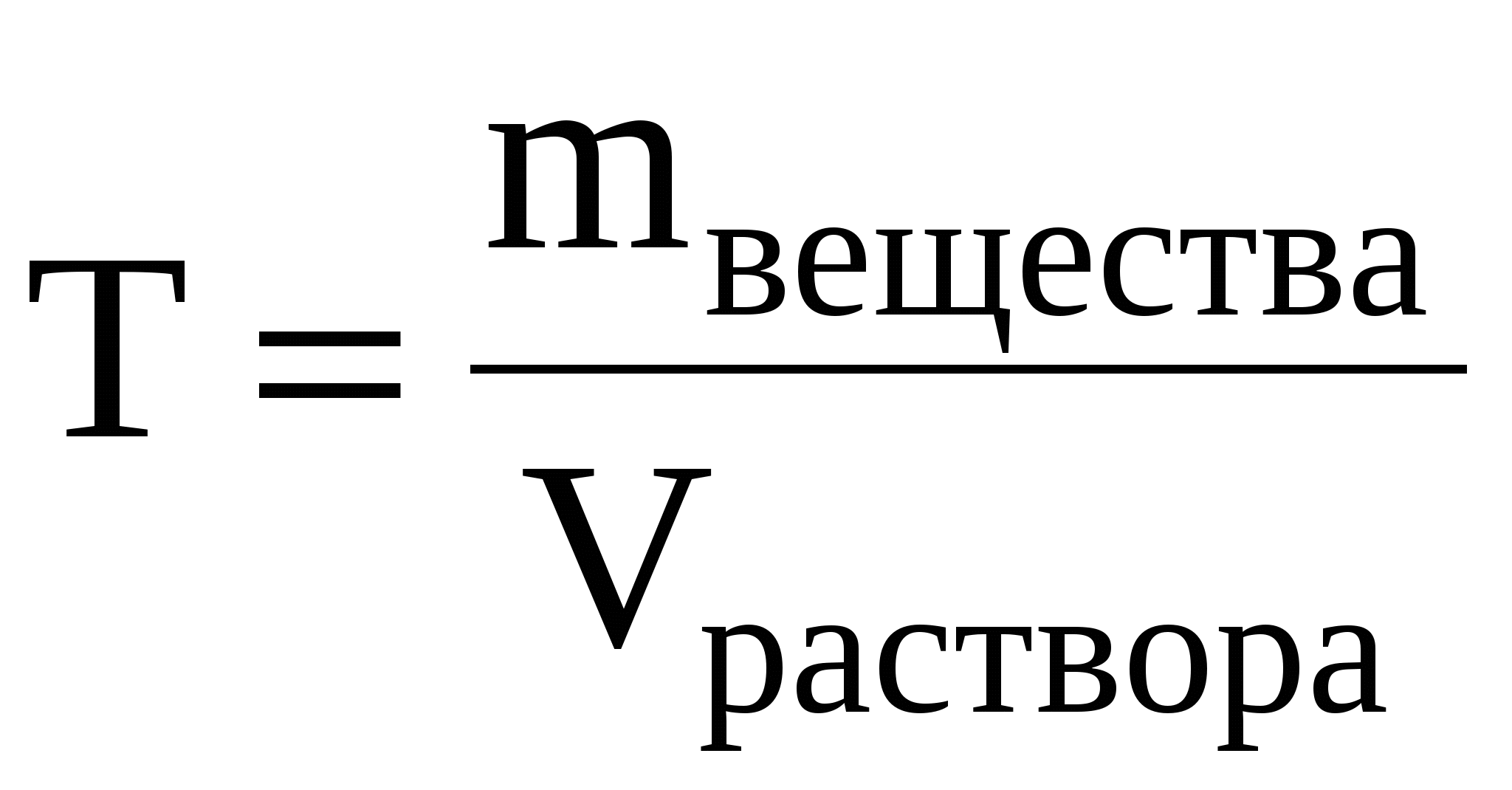
Титр имеет размерность г/мл, он показывает, сколько грамм вещества растворено в 1 мл раствора.
Моляльная концентрация или моляльность (m) – это величина, равная отношению количества растворённого вещества к массе растворителя, выраженной в кг, т.е.
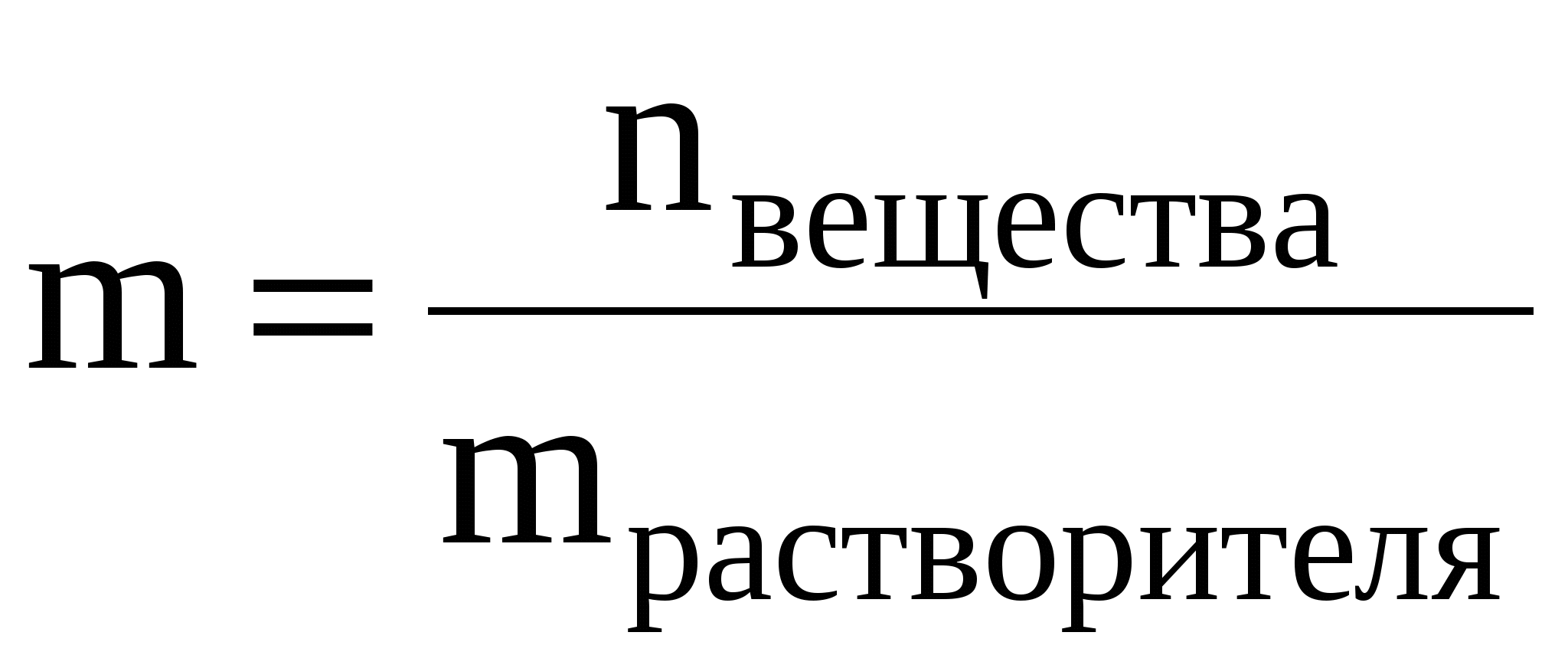
Моляльность имеет размерность моль/кг и показывает, какое количество вещества растворено в 1 кг растворителя.
Мольная доля (Х) – это величина, равная отношению количества растворённого вещества к общему количеству вещества в растворе:
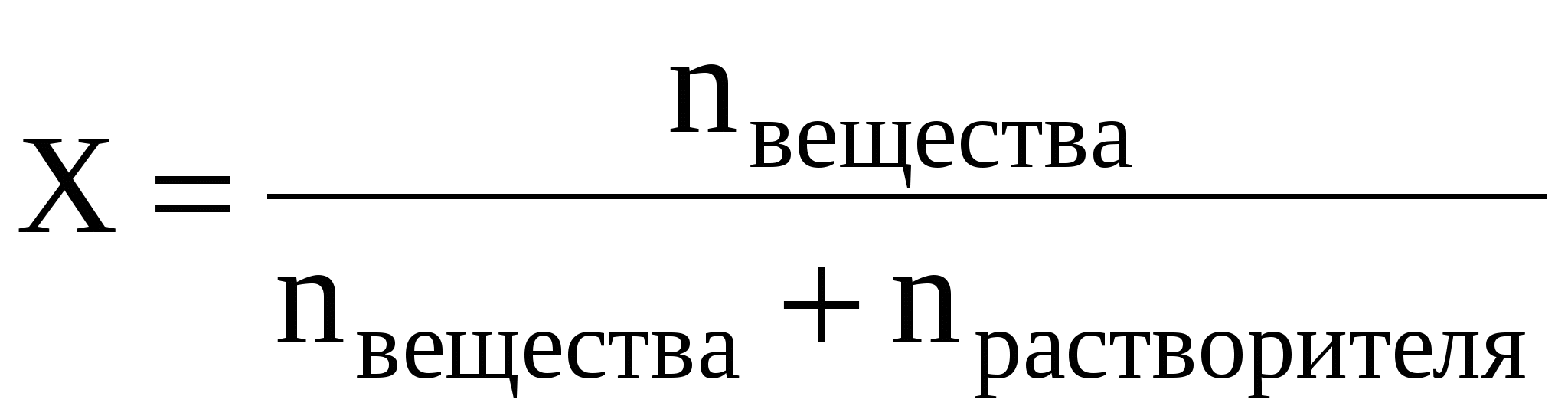
Мольная доля – это безразмерная величина и измеряется в долях единицы или в %.
Молярная концентрация химического эквивалента вещества (С) или нормальная концентрация – это величина, равная отношению количества химического эквивалента растворённого вещества к объему раствора (в литрах),т.е.
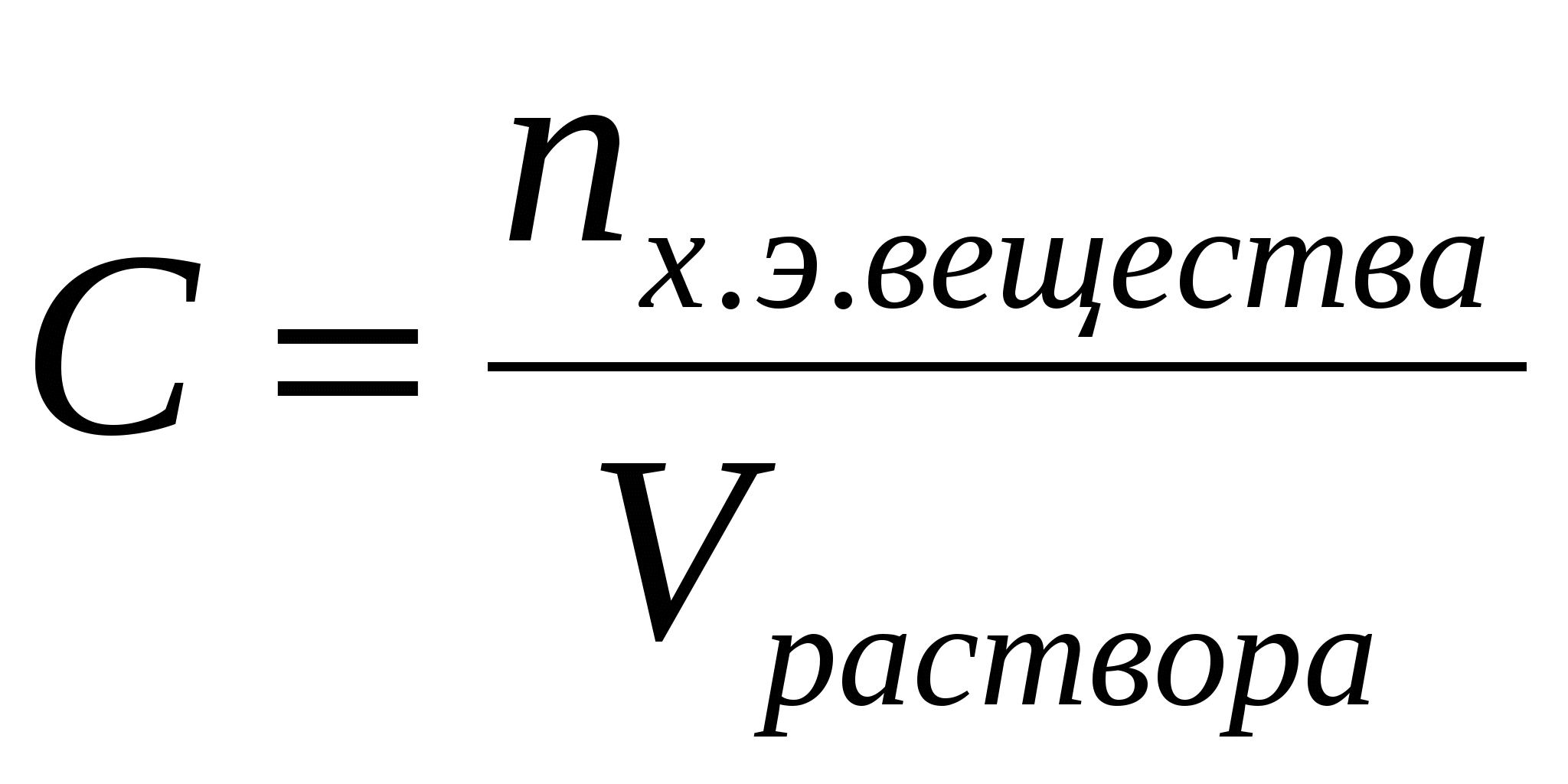
Молярная концентрация химического эквивалента вещества измеряется в моль/л и показывает, сколько моль эквивалента вещества растворено в одном литре раствора. Она обозначается обычно буквой н. Если в одном литре раствора содержится 1 моль химического эквивалента вещества, такой раствор называется однонормальным (1н), если 0,1 моль вещества –децинормальным(0,1н), если 0,01 моль вещества – сантинормальным(0,01н), если 0,001 моль вещества –миллинормальным (0,001н).
27. Растворимость. Равновесие в гетерогенных системах. Произведение растворимости малорастворимых неорганических веществ. Условия образования и растворения осадков.
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
Равновесия между различными фазами одной системы называют фазовыми, а описывают эти фазовые равновесия посредством фазовых диаграмм или диаграмм состояния. Фазовая диаграмма позволяет установить условия равновесия между числом фаз, числом компонентов и числом степеней свободы (вариантностью) системы.
Фаза (Ф) – гомогенная (однородная по химическому составу и термодинамическим свойствам) часть системы, отделенная от других частей поверхностью раздела. Так, два нерастворимых друг в друге твердых вещества, как и две несмешивающиеся жидкости, образуют две фазы.
Компоненты (К) – химически индивидуальные вещества, наименьшее число которых достаточно для образования фаз системы.
Число компонентов определяется количеством индивидуальных веществ в системе за вычетом числа возможных между ними обратимых взаимодействий. Например, система из трех индивидуальных веществ H2O, H2, O2 будет двухкомпонентной, поскольку для образования всех фаз достаточно любых двух веществ:
 = H2 + 1/2O2. = H2 + 1/2O2. |
По числу компонентов системы делятся на одно-, двух-, трех- и многокомпонентные.
Степени свободы (С) – число параметров (температура, давление, состав системы), которые можно произвольно менять без изменения числа фаз в системе.
Правило фаз Гиббса: в изолированной равновесной системе число степеней свободы равно числу компонентов системы плюс два минус число фаз:
|
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
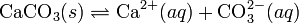
Константа этого равновесия рассчитывается по уравнению:
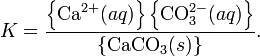
В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
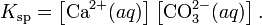
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению:
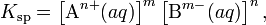
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
28. Водные растворы неэлектролитов. Давление насыщенного пара разбавленного раствора, температура кипения и температура кристаллизации разбавленных растворов. Осмотическое давление разбавленных растворов.
Неэлектролитами называются вещества, растворы которых не проводят электрический ток. Неэлектролиты – это вещества с неполярной или малополярной ковалентной связью, в растворах они находятся в виде молекул.
Разбавленные растворы неэлектролитов проявляют коллигативные свойства, то есть такие свойства и закономерности, которые зависят только от количества частиц в растворе (концентрации) и не зависят от природы этих частиц.
Первый закон Рауля.
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
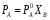 ,
,
где РA0 – давление пара чистого растворителя, РA – давление пара растворителя над раствором, ХB – мольная доля растворенного вещества.
Этот закон можно выразить в другом виде:
Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества.
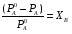 .
.
Второй закон Рауля. Изменение температуры кристаллизации и температуры кипения раствора
Замерзание растворов можно охарактеризовать величиной понижения температуры замерзания ΔТзам, равной разности между температурой замерзания чистого растворителя 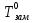 и температурой начала кристаллизации раствора Tзам:
и температурой начала кристаллизации раствора Tзам:
ΔTзам. = T0зам.–.
Понижение температуры замерзания раствора ΔTзам прямо пропорционально моляльной концентрации раствора:
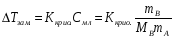 ,
,
где Kкрио – криоскопическая постоянная растворителя – определяется природой растворителя (для воды Kкрио =1,86), В – растворенное вещество, A растворитель
Температура кипения растворов нелетучего вещества всегда выше, чем температура кипения чистого растворителя при том же давлении.
Повышение температуры кипения растворов нелетучих веществ ΔTкип = Tкип – 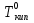 пропорционально понижению давления насыщенного пара и, следовательно, прямо пропорционально моляльной концентрации раствора. Коэффициент пропорциональности E есть эбулиоскопическая постоянная растворителя (для воды Е=0,52), не зависящая от природы растворенного вещества.
пропорционально понижению давления насыщенного пара и, следовательно, прямо пропорционально моляльной концентрации раствора. Коэффициент пропорциональности E есть эбулиоскопическая постоянная растворителя (для воды Е=0,52), не зависящая от природы растворенного вещества.
ΔTкип = ECмл = Е 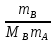 .
.
В общем виде второй закон Рауля:
Понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества.
Второй закон Рауля является следствием из первого; данный закон справедлив только для бесконечно разбавленных растворов.
Осмотическое давление прямо пропорционально молярной концентрации раствора (СМ) и абсолютной температуре (Т). Эта зависимость дается уравнением Вант-Гоффа:
Росм=СМRT,
где R – универсальная газовая постоянная, значение которой определяется принятыми единицами измерения. Если давление измерять в Па, а объем в м3, то R=8,3144∙103Дж∙моль-1∙К-1; Т – абсолютная температура.
Поскольку СМ=n/V, то уравнение Вант-Гоффа аналогично уравнению Менделеева-Клапейрона, которое характеризует газовое состояние вещества:
РосмV=nRT или 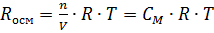 ,
,
где n – число молей растворенного вещества; V – объем раствора. Заменяя СМ в выражении Р=СМRT его выражением по формуле для молярной концентрации 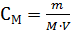 , где m – масса растворенного вещества; М – молярная масса растворенного вещества, получим формулу, удобную для вычисления молярной массы растворенного вещества.
, где m – масса растворенного вещества; М – молярная масса растворенного вещества, получим формулу, удобную для вычисления молярной массы растворенного вещества.
29. Водные растворы электролитов. Сильные и слабые электролиты. Константа и степень диссоциации.
Количественная характеристика диссоциации электролитов называется степенью диссоциации (обозначение α); для веществ-электролитов всегда больше нуля (α = 0 в случае неэлектролитов). Степень диссоциации может выражаться как в долях от 1, так и в процентах.
Для сильных электролитовв водном растворе по определению α = 1: диссоциация таких электролитов протекает необратимо(до конца), и степень превращения растворенного вещества в ионы полная.
Для слабых электролитовстепень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе):
α = cд / cB
всегда меньше единицы, но больше нуля (0 < α < 1).
В случае слабых кислот состава HnA степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей:
H3PO4 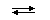 H+ + H2PO4− (α = 23,5%)
H+ + H2PO4− (α = 23,5%)
H2PO4− 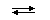 H+ + HPO42− (α = 3*10−4%)
H+ + HPO42− (α = 3*10−4%)
HPO42− 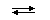 H+ + PO43− (α = 2*10−9%)
H+ + PO43− (α = 2*10−9%)
Причина этого состоит в том, что в соответствии с принципом Ле-Шателье происходит смещение химического равновесия в каждой последующей стадии диссоциации под действием катионов водорода, образовавшихся в результате диссоциации в каждой предыдущей стадии.
Степень диссоциации α зависит от природы и концентрации электролита, а также от температуры раствора. Так, α растет при нагревании (поскольку диссоциации - процесс эндотермический, нагревание смещает равновесие вправо, в сторону продуктов диссоциации). При уменьшении концентрации вещества в растворе (то есть при разбавлении) степень диссоциации также увеличивается.
В разбавленных растворах сильных кислот HnA их гидроанионы Hn-1A не существуют. Например, в случае серной кислоты:
H2SO4 = H+ + [HSO4−] (α1 → 1)
[HSO4−] = H+ + SO42− (α2 → 1)
H2SO4 (разб.) = 2H+ + SO42−
В концентрированныхрастворах содержание гидроанионов (иногда - и исходных молекул) становится заметным:
H2SO4 (конц.) 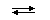 H+ + HSO4− (α1 < 1)
H+ + HSO4− (α1 < 1)
HSO4− 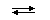 H+ + SO42− (α2 < α1 < 1)
H+ + SO42− (α2 < α1 < 1)
(суммировать уравнения стадий обратимой диссоциации нельзя!)
При нагревании значения 1 и 2 возрастают, что способствует протеканию реакций с участием концентрированных кислот.
Электролитическая диссоциация — обратимый равновесный процесс. Поэтому для диссоциации, так же как и для других, можно записать выражение для константы равновесия.
В общем виде диссоциация электролита AnBm происходит по уравнению:
AnBm nAm++mBn- (1)
Следовательно, константа равновесия будет равна:
K=[Am+]n[Bn-]m/[AnBm]
где константа равновесия К называется константой диссоциации KD, [Am+], [Bn- ] и [AnBm] — соответствующие концентрации, выраженные в моль/л.
Константа диссоциации зависит только от температуры, но не зависит от концентрации раствора.
Помимо константы диссоциации, существует еще одна количественная характеристика поведения электролита в растворе.
Степень диссоциации — это отношение числа молекул, распавшихся на ионы, к общему числу растворившихся молекул.
a=n/N,
где n — число молекул, распавшихся на ионы, а N —общее число растворенных молекул. Поскольку n£N, то соответственно соответственно 0<a<1(или в процентах: 0<a<100%).
По степени диссоциации электролиты разделяются на слабые, средние и сильные. 
Если значение a близко к нулю (или к 0% ), то это значит, что диссоциации нет, и такие электролиты называют слабыми. Если a®1 (или a®100%), то говорят, что диссоциация полная, а электролит — сильный.
Сильными электролитами являются многие хорошо растворимые кислоты, имеющие молекулярное строение: серная, хлороводородная, азотная, хлорная, бромоводородная и др. Сильными электролитами являются также все ионные соединения (все соли и гидроксиды), даже если они плохо растворимы, поскольку они не могут существовать в растворе в молекулярном виде.
Слабые электролиты — это такие кислоты, как сернистая» борная, уксусная и большинство органических кислот, и вода.
Степень диссоциации, в отличие от константы диссоциации, зависит от концентрации. Чем меньше концентрация, тем выше значение а. Эта зависимость выполняется для всех электролитов (сильных и слабых), имеющих молекулярное строение. Степень диссоциации ионных электролитов от концентрации не зависит, т.к. для них всегда а = 1.
Закон разбавления Оствальда— соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
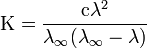
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
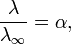
где α — степень диссоциации.
30. Электролитическая диссоциация воды. Константа диссоциации воды. Ионное произведение воды.
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды. Вывод значения ионного произведения воды
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−илиH2O ↔ H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
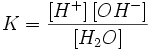
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8Ч10−16моль/л. Уравнение (1) можно переписать как: 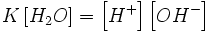 Обозначим произведение K·[H2O] = Kв = 1,8Ч10−16 моль/л·55,56 моль/л = 10−14мольІ/лІ = [H+]·[OH−] (при 25 °C).
Обозначим произведение K·[H2O] = Kв = 1,8Ч10−16 моль/л·55,56 моль/л = 10−14мольІ/лІ = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот. Практическое значение ионного произведения воды
Практическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH−]) найти соответственно концентрации [OH−] или [H+]. Хотя в большинстве случаев для удобства представления пользуются не абсолютными значениями концентраций, а взятыми с обратными знаком их десятичными логарифмами — соответственно, водородным показателем (pH) и гидроксильным показателем (pOH).
Так как Kв — константа, при добавлении к раствору кислоты (ионов H+), концентрация гидроксид-ионов OH− будет падать и наоборот. В нейтральной среде [H+] = [OH−] = 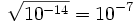 моль/л. При концентрации [H+] > 10−7 моль/л (соответственно, концентрации [OH−] < 10−7 моль/л) среда будет кислой; При концентрации [OH−] > 10−7 моль/л (соответственно, концентрации [H+] < 10−7 моль/л) — щелочной.
моль/л. При концентрации [H+] > 10−7 моль/л (соответственно, концентрации [OH−] < 10−7 моль/л) среда будет кислой; При концентрации [OH−] > 10−7 моль/л (соответственно, концентрации [H+] < 10−7 моль/л) — щелочной.
Электролитическая диссоциация воды. Водородный показатель рН
Вода представляет собой слабый амфотерный электролит:
Н2О Н+ + ОН-или, более точно:2Н2О Н3О+ + ОН-
Константа диссоциации воды при 25оС равна: 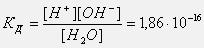 Такое значение константы соответствует диссоциации одной из ста миллионов молекул воды, поэтому концентрацию воды можно считать постоянной и равной 55,55 моль/л (плотность воды 1000 г/л, масса 1 л 1000 г, количество вещества воды 1000г:18г/моль=55,55 моль, С=55,55 моль: 1 л = 55,55 моль/л). Тогда
Такое значение константы соответствует диссоциации одной из ста миллионов молекул воды, поэтому концентрацию воды можно считать постоянной и равной 55,55 моль/л (плотность воды 1000 г/л, масса 1 л 1000 г, количество вещества воды 1000г:18г/моль=55,55 моль, С=55,55 моль: 1 л = 55,55 моль/л). Тогда
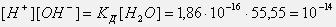
Эта величина постоянная при данной температуре (25оС), она называется ионным произведением воды KW:
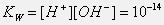
Так как диссоциирована лишь ничтожная доля молекул воды, то равновесную концентрацию недиссоциированных молекул, равную 55,6 моль/л, можно считать постоянной. Произведение двух постоянных величин K[Н2О] можно представить в виде одной константы:
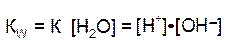
Константа Кw, равная произведению концентраций ионов Н+ и ОН-, величина постоянная при данной температуре, получила название ионное произведение воды.
31. Водородный показатель рН среды для растворов электролитов. Шкала рН. Формулы для расчета рН для сильных и слабых кислот и оснований.
Концентрация катионов водорода [H+] обычно выражается очень малыми величинами. Для большего удобства принято пользоваться отрицательным значением десятичного логарифма молярной концентрации ионов [H+], который назван водородным показателем, и обозначается рН:
рН = –lg [H+], где [H+] - молярная концентрация ионов H+. Следовательно: [H+]= 10–pH
Если реакция среды нейтральная, то [H+] = 10–7 [моль/л], и рН=7. Если реакция среды кислая, то [H+]>10–7 [моль/л], и рН<7. Если среда щелочная, то [H+]<10–7 [моль/л], и рН>7. По аналогии рН введен гидроксильный показатель (рОН):
рОН = –lg [ОH-], где [ОH-] - молярная концентрация ионов ОH-. А также показатель константы воды: рКВ = –lg КВ . Логарифмируя ионное произведение воды, получаем выражение: –lg [H+][OH–] = –lg 10–14 и далее: pH + pOH = 14.
1. Поскольку диссоциация сильной кислоты (HNO3, HCl, H2SO4, HI, HBr, HСlO4) протекает практически полностью, можно считать: [H+] = Скисл., где Скисл - молярная концентрация кислоты.
HNO3 H+ + NO3– (сильная кислота - сильный электролит)
Расчет рН сильной кислоты проводят по уравнению
рН = - lgаН+ = - lgfН+[H+], где аН+ - активная концентрация, моль/л.
2. При расчете рН слабых электролитов обычно принимают ионную силу раствора (I) равной нулю, коэффициент активности (f) равным 1 и рН = - lg[H+].
HNO2 H+ + NO2– (слабая кислота - слабый электролит)
Концентрация ионов водорода в растворе слабых кислот определяют по закону разведения Оствальда:

,где α – степень диссоциации кислоты, Скисл – молярная концентрация кислоты, Ккисл – константа диссоциации кислоты, характеризует силу кислоты: чем меньше константа диссоциации, тем слабее кислота.
