Хим-ое равновесие. Константа хим-ого равновесия. Способы нарушения хим-ого равновесия. Принцип Ле-Шателье. Кинетика гетерогенных реакций
Состояние равновесия характерно для обратимых химических реакций.
Обратимая реакция - химическая реакция, которая при одних и тех же условиях может идти в прямом и в обратном направлениях.
Необратимой называется реакция, которая идет практически до конца в одном направлении.
Примеры:

Химическое равновесие - состояние системы, в котором скорость прямой реакции равна скорости обратной реакции.
Концентрации всех веществ в состоянии равновесия (равновесные концентрации) постоянны. Химическое равновесие имеет динамический характер. Это значит, что и прямая и обратная реакции при равновесии не прекращаются.
Для одностадийной обратимой реакции
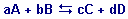
при равновесии выражения для скоростей прямой V1 и обратной реакций V2 имеют вид:
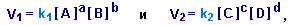
где [A], [B], [C] и [D] - равновесные молярные концентрации веществ A, B, C и D;
a,b,c и d - соответствующие стехиометрические коэффициенты (при условии, что реакция идет в одну стадию);
k1 и k2 -коэффициенты пропорциональности, называемые константами скоростей.
Из условия равновесия V1=V2 следует:
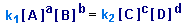
Отсюда получаем выражение для константы равновесия Kp:
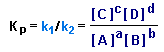
Чем выше величина Kp, тем больше в равновесной смеси продуктов прямой реакции.
Смещение равновесия в нужном направлении достигается изменением условий реакции (принцип Ле-Шателье).
Если значения константы равновесия больше 1, значит равновесие сдвинуто в сторону продуктов реакции, если меньше 1, то в сторону исходных веществ.
Смещение или сдвиг хим-ого равновесия подчиняется «принципу Ле-Шателье»:
Если на систему, находящуюся в равновесии, оказать внешнее воздействие (изменение T, С и т.д.), то равновесие сдвинется в сторону того процесса, который будет компенсировать эффект внешнего воздействия.
После этого система перейдёт в новое равновесное состояние.
Кинетика гетерогенных химических реакций:
Когда реакция совершается между веществами, находящимися в разных фазах гетерогенной системы, основной постулат химической кинетики становится неприменимым. В гетерогенных реакциях роль промежуточных продуктов обычно играют молекулы, связанные химическими силами с поверхностью раздела фаз (химически адсорбированные на поверхности). Во всяком гетерогенном химическом процессе можно выделить следующие стадии:
1. Диффузия реагентов к реакционной зоне, находящейся на поверхности раздела фаз.
2. Активированная адсорбция частиц реагентов на поверхности.
3. Химическое превращение адсорбированных частиц.
4. Десорбция образовавшихся продуктов реакции.
5. Диффузия продуктов реакции из реакционной зоны.
Стадии 1 и 5 называются диффузионными, стадии 2, 3 и 4 – кинетическими. Универсального выражения для скорости гетерогенных химических реакций не существует, поскольку каждая из выделенных стадий может являться лимитирующей. Как правило, при низких температурах скорость гетерогенной реакции определяют кинетические стадии (т.н. кинетическая область гетерогенного процесса; скорость реакции в этом случае сильно зависит от температуры и величины площади поверхности раздела фаз; порядок реакции при этом может быть любым). При высоких температурах скорость процесса будет определяться скоростью диффузии (диффузионная область гетерогенной реакции, характеризующаяся, как правило, первым порядком реакции и слабой зависимостью скорости процесса от температуры и площади поверхности раздела фаз).
