Сущность гравиметрического анализа
Гравиметрический анализ основан на определении массы вещества.
В ходе гравиметрического анализа определяемое вещество или отгоняется в виде какого-либо летучего соединения (метод отгонки), или осаждается из раствора в виде малорастворимого соединения (метод осаждения).
Метод отгонки определяет, например, содержание кристаллизационной воды в кристаллогидратах, если вещество при нагревании не претерпевает других химических изменений, кроме выделения воды:
BaCl2×2H2O (кр) = BaCl2 (кр) + 2H2O (г)
Для определения содержания SiO2 часто используют реакцию с фтороводородной (плавиковой) кислотой, в результате которой образуется летучий SiF4:
SiO2+4НF = SiF4+2H2O
Метод отгонки применяют также при анализе карбонатов, некоторых нитратов и других соединений, образующих летучие продукты реакции. Содержание анализируемого компонента определяют по изменению массы вещества в результате термической обработки (обычно, уменьшению) или по увеличению массы поглотителя газообразных продуктов реакции.
Методы осаждения применяются более широко и их практическое значение намного больше, чем методов отгонки.
Соединение, в виде которого определяемый компонент осаждается из раствора, называется формой осаждения.
Например, при осаждении сульфата формой осаждения является BaSO4, при осаждении железа (III) – соответствующий гидроксид Fe(OH)3. После фильтрования и промывания осадок высушивают или прокаливают до постоянной массы и взвешивают.
Соединение, в виде которого производят взвешивание, называют гравиметрической формой.
При высушивании и прокаливании осадков могут происходить химические процессы, например:
2Fe(OH)3 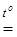 Fe2O3 + 3Н2О
Fe2O3 + 3Н2О
СаС2О4 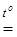 СаCO3 + CO
СаCO3 + CO
СаCO3 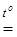 CaO+CO2
CaO+CO2
Гравиметрическая форма по составу может отличаться от формы осаждения. Нередко, форма осаждения и гравиметрическая форма совпадают, как это видно на примере BaSO4.
Форма осаждения
К форме осаждения предъявляются следующие основные требования:
- осадок должен быть малорастворим, т.е. осаждение должно быть достаточно полным;
- полученный осадок должен бить чистым и легко фильтрующимся.
Необходимо также, чтобы из формы осаждения легко получалась гравиметрическая форма.
Решающее влияние на полноту осаждения и свойства осадков оказывают следующие условия:
- концентрация (количество) осадителя;
- температура;
- концентрация посторонних солей.
Полнота осаждения
Путь, например, SO 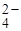 осаждается ионами Ba2+ в виде ВаSO4. Концентрация ионов SO
осаждается ионами Ba2+ в виде ВаSO4. Концентрация ионов SO 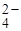 и Ва2+ в растворе над осадком будут определяться произведением растворимости:
и Ва2+ в растворе над осадком будут определяться произведением растворимости:
SPBaSO4 = [Ва2+] [SO 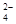 ] r2±
] r2±
Требование полноты осаждения сульфата вовсе не означает, что концентрация сульфат-иона в растворе после осаждения должна быть равна нулю, так как ПР – величина конечная. 1,0·10-6 моль/л ‑ это означает часто принимают как количественный критерий полноты осаждение. Найдем, при какой концентрации ионов Ba2+ сульфат будет полностью осажден из раствора, если условием полноты осаждения считать [SO4-2] ≤ 1·10-6 моль/л. Подставляем это значение в выражение произведения растворимости:
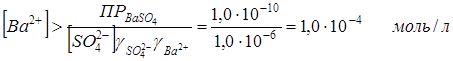 .
.
Коэффициенты активности для простоты расчета принимаем равными 1.
ПР зависит от температуры. Эта зависимость выражается известным в химической термодинамике уравнением изобары реакции. Процесс растворения малорастворимой соли обычно эндотермичен, т.е. ∆Н > 0, и следовательно, 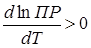 , т.е. с ростом температуры ПР растет. Таким образом, с точки зрения полноты осаждения низкая температура является благоприятным условием. Влияние температуры на полноту осаждения оказывается практически несущественным, так как полнота осаждения достигается при всех температурах.
, т.е. с ростом температуры ПР растет. Таким образом, с точки зрения полноты осаждения низкая температура является благоприятным условием. Влияние температуры на полноту осаждения оказывается практически несущественным, так как полнота осаждения достигается при всех температурах.
Таким образом, для достижения полноты осаждения необходим избыток осадителя и нежелательны посторонние электролиты, вызывающие уменьшение коэффициентов активности и, как следствие, возрастание растворимости осадка. Однако чрезмерно большой избыток осадителя также нежелателен, так как это может привести к частичному растворению осадка за счет комплексообразования и солевого эффекта: кроме того, избыток осадителя увеличивает загрязнения осадка вследствие соосаждения.
Чистота осадка
Образование осадков является сложным физико-химическим процессом, закономерности протекания которого раскрыты не полностью. Образование незагрязненных крупнокристаллических осадков является необходимым условием получения точных результатов в гравиметрическом анализе. Крупнокристаллические осадки получаются более чистыми, чем мелкокристаллические или аморфные, так как имеют менее развитую поверхность и поэтому адсорбируют меньше примесей и, кроме того, крупнокристаллические осадки могут забивать поры фильтра и тогда скорость фильтрования падает практически до нуля.
На размер кристаллов оказывают влияние относительные скорости двух основных процессов: скорость образования центров кристаллизации и скорость роста кристаллов. При небольшой скорости образования центров кристаллизации по сравнению со скоростью роста кристаллов в растворе будет происходить образование небольшого числа крупных кристаллов.
Скорость образования центров кристаллизации, а следовательно, и их число зависят от величины относительного пересыщения (ОП) раствора, которое выражается:
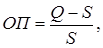
где Q – концентрация осаждаемого компонента;
S – его растворимость.
Чем больше относительное пересыщение, тем больше скорость образования центров кристаллизации и тем мельче будут образующиеся кристаллы. Для уменьшения числа центров кристаллизации в растворе в соответствии с формулой, необходимо уменьшить Q и увеличить S. По этой причине перед осаждением многих веществ раствор рекомендуется разбавить для уменьшения Q и нагреть для увеличения S, а также ввести электролит, чаще всего соли аммония, для увеличения S или с этой же целью подкислить раствор.
Еще более эффективным приемом равномерного введения небольших концентраций осадителя является осаждение из гомогенного раствора (гомогенное осаждение), или метод возникающих реактивов. В этом методе осадитель образуется в результате гидролиза специально введенного реагента в анализируемом растворе. Например, при осаждении оксалата кальция в кислый раствор, содержащий ионы Са2+ и щавелевую кислоту, вводят карбамид, который при нагревании медленно гидролизуется:
(NH2)2CO + H2O = 2NH3 + CO2
Образующийся аммиак уменьшает кислотность раствора, что приводит к медленному увеличению концентрации С2О4- ионов и, как следствие, к осаждению крупнокристаллического осадка оксалата кальция. Сульфат-ион в растворе по этому методу получают при гидролизе диметил- или диэтилсульфата:
(CH3)2SO4 + 2H2O = 2 CH3OH + HSO4- + H+,
а фосфат – при гидролизе триметилфосфата.
Основными причинами, вызывающими загрязнение осадков, являются процессы адсорбции и окклюзии. Чем мельче кристаллы осадка, тем больше их суммарная поверхность и тем больше число ионов будет на них адсорбировано. С этой точки зрения в гравиметрическом анализе более предпочтительными являются крупнокристаллические, а не аморфные осадки с сильно развитой поверхностью.
При повышении температуры адсорбция уменьшается, что приводит к по лучению более чистых осадков.
Для уменьшения загрязнения за счет соосаждения часто применяют настаивание; кристаллический осадок вместе с маточным раствором выдерживают более или менее длительное время, в течение которого в системе раствор – осадок протекают сложные физико-химические процессы, называемые старением осадка. Длительность старения или созревания различных осадков колеблется в очень широких пределах (от 0,5 до 10…20 ч), а нередко раствор с осадком рекомендуется оставить на ночь. В процессе старения происходит рекристаллизация первичных частиц, растворение мелких и рост крупных кристаллов, поскольку растворимость кристаллов с уменьшением их размера увеличивается, превращение осадка в устойчивую модификацию и т.д. При этом протекает также обменная адсорбция, сущность которой заключается в замене ионов, не удаляющихся при прокаливании осадка, на ионы удаляющиеся, большей частью на ионы аммония, соли которых при прокаливании образуют газообразные продукты разложения и таким образом не вносят погрешности при взвешивании осадка. Во многих аналитических прописях рекомендуется проводить осаждение в присутствии солей аммония. Одной из основных причин такой рекомендации является создание условий для обменной адсорбции, т.е. для замены адсорбированных ионов на ионы аммония.
Наиболее радикальным средством борьбы с загрязнением осадка является переосаждение, или повторное осаждение. Для этого осадок фильтруют, промывают на фильтре, растворяют в кислоте и снова осаждают. Содержание примесей в полученном таким образом осадке резко снижается.
Сопоставление условий, при которых достигается полнота осаждения и получается крупнокристаллический чистый осадок, показывает, что на первый взгляд они довольно противоречивы. Для достижения полноты осаждения нужна низкая температура (чтобы понизить ПР), а для получения чистых, легко фильтрующихся крупнокристаллических осадков необходимо вести осаждение из горячих растворов. Для полноты осаждения требуется избыток осадителя, а для получения чистых крупнокристаллических осадков следует ограничиваться минимальным количеством осадителя и т.д. Противоречия здесь чисто кажущиеся. Требования, относящиеся к образованию чистых крупнокристаллических осадков (горячие растворы, концентрация осадителя и т.д.), соблюдаются в начале осаждения, когда идет формирование кристаллов, а для обеспечения полноты осаждения в конце процесса следует добавить избыток осадителя. Конкретные рекомендации о количестве осадителя и других условиях осаждения обычно указываются в аналитических прописях.
Промывание осадков
Крупнокристаллические легко фильтрующиеся осадки промывают непосредственно на фильтре. Аморфные студенистые осадки обычно перед перенесением на фильтр промывают декантацией, сливая прозрачную жидкость над осадком через фильтр и снова взмучивая осадок промывной жидкостью и опять ее сливая. Промывание декантацией часто применяют при переосаждении. При этом первичный осадок совсем не переносят на фильтр, а после промывания декантацией растворяют и переосаждают, не забывая, разумеется, и ту небольшую массу осадка, которая могла оказаться на фильтре при промывании декантацией.
Осадок на фильтре промывают небольшими порциями промывной жидкости, так как при одном и том же общем объеме промывных вод многократная промывка небольшими порциями является более эффективной, чем при меньшем числе раз большими порциями жидкости.
В качестве промывной жидкости только в редких случаях применяют воду. Обычно берут раствор соли аммония, имеющей общий ион с осадком, разбавленный раствор аммиака или азотной кислоты или какого-либо другого электролита.
Гравиметрическая форма
На заключительной стадии анализа осадок (форму осаждения) после фильтрования и промывания высушивают или прокаливают и получают в результате такой термической обработки гравиметрическую форму – соединение, пригодное для взвешивания. Высушивание или прокаливание осадка продолжают до тех пор, пока его масса не станет постоянной, что обычно рассматривается как критерий достигнутой полноты превращения формы осаждения в гравиметрическую форму и указывает на полноту удаления летучих примесей – растворителя, адсорбированных солей аммония и т.д.
Главное требование к гравиметрической форме: необходимость точного соответствия ее состава определенной химической формуле, так как только тогда по массе осадка можно рассчитать содержание анализируемого компонента в пробе. Гравиметрическая форма должна обладать также определенной химической устойчивостью в некотором достаточно широком интервале температур, оставаться устойчивой на воздухе при обычной температуре, то есть не быть гигроскопичной и не реагировать с другими компонентами окружающей атмосферы.
Желательно, чтобы у гравиметрической формы была большая относительная молекулярная масса, и содержание определяемого элемента в ней было возможно меньшим.
Расчеты в гравиметрическом анализе
Если т - масса гравиметрической формы, например BaSO4, а в результате анализа требуется определить массу серы S, то результат можно рассчитать по простой пропорции. Обозначим молярную массу BaSO4, как М(BaSO4), молярную массу S как М(S). Составим пропорцию:
из М(BaSO4) г BaSO4 получается М(S) г S
«m(BaSO4) « « « х « S.
Решая эту пропорцию, получаем:
х=m(BaSO4) 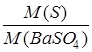 .
.
Отношение молярной массы определяемого компонента к молярной массе гравиметрической формы называют фактором пересчета, или гравиметрическим фактором (множителем), или просто фактором и обозначают буквой F. Следовательно, х=mF.
Титриметрический анализ
Основан на определении объемов растворов (взаимодействующих веществ), концентрация одного из которых известна.
По используемым реакциям различают:
1. Методы кислотно-основного титрования (нейтрализации)
Определяют кислоты, щелочи, гидролизующиеся соли. Используются индикаторы, изменяющие окраску в зависимости от рН среды.
2. Методы окисления-восстановления (редоксиметрия)
- перманганатометрия, рабочий раствор КМnО4 является окислителем; определяют Fe2+, NO2−, CNS−;
- йодометрия, рабочий раствор I2 – окислитель, вспомогательный раствор KI – восстановитель; определяют KMnO4, MnO2, Cl2, Na2SO3 Cu2+;
- хроматометрия, K2Cr2O7 – окислитель;
- броматометрия, KВrO3 – окислитель;
- ванадатометрия, рабочий раствор NH4VO3 – окислитель;
- цериметрия, окислитель и рабочий раствор − соединия Се (IV).
3. Методы осаждения – определяемый элемент переходит в осадок.
По применяемому рабочему раствору существует
- аргентометрия (AgNO3);
- роданометрия (NH4CNS);
- меркурометрия (Hg22+).
4. Методы комплексообразования.
Основаны на образовании комплексных ионов. Используются комплексоны (трилон Б).
Способы титрования:
1) прямого титрования;
2) обратного титрования (избытка);
3) замещения.
Исходные и рабочие титрованные растворы
Титрованные растворы – растворы с точно известной концентрацией. Первичный стандартный (исходный) раствор готовят из веществ, которые должны удовлетворять ряду требований.
В качестве веществ для исходных растворов обычно применяют буру
Na2B4O7·10H2O, щавелевую кислоту H2C2O4·2H2O, оксалат натрия Na2C2O4, янтарную кислоту H2C4H4O4, KCl, NaCl, K2Cr2O7, Na2CO3 и т.д.
В качестве вторичных стандартных растворов, которые называют также рабочими растворами или титрантами, применяют H2SO4 (стандартизируют по тетраборату натрия), КОН (стандартизируют по щавелевой кислоте), Na2S2O3 (стандартизируют по дихромату калия) и т.д.
| Требования к веществам |
| Чистые | Состав соответствует формуле |
| Устойчивы | Большая эквивалентная масса |
Таким образом в титриметрии существует следующая последовательность определения характеристик растворов: первичный стандартный → вторичный стандартный (титрант) → исследуемый раствор.
