Количественная оценка процесса гидролиза
Показателем глубины протекания гидролиза является степень гидролиза.
Степенью гидролиза β называется отношение концентрации гидролизованных молекул Сгидр к исходной концентрации растворенных молекул электролита Со.
β = Сгидр / Со. (11)
Степень гидролиза как правило невелика. Это объясняется тем, что один из участников процесса гидролиза – вода – является слабым электролитом и равновесие в системе сильно смещено в сторону исходных веществ. Степень гидролиза можно увеличить:
1) разбавлением раствора, что объясняется принципом Ле - Шателье;
2) нагреванием, т.к. при этом возрастает доля молекул, подвергшихся гидролизу.
Гидролиз, как любой обратимый процесс, количественно можно охарактеризовать константой равновесия .
Константа равновесия Кс показывает отношение произведения равновесных концентраций продуктов гидролиза к произведению концентраций исходных веществ, взятых в степени, равной коэффициенту перед формулой данного вещества в уравнении реакции гидролиза.
Например, напишем выражение константы равновесия для реакции гидролиза сульфита калия K2SO3 по первой ступени:
SO32- + HOH ↔ HSO3- + OH-
Кс = [HSO3-][ OH-] / [SO32-][ HOH] или
Кс [ HOH] = [HSO3-][ OH-] / [SO32-]
Обозначая Кс [ HOH] через Кг, получаем
Кг= [HSO3-][ OH-] / [SO32-], (12)
где Кг – константа гидролиза.
Часто для расчетов константы гидролиза пользуются формулой:
Кг = КВ / КД , (13)
где КВ – ионное произведение воды;
КД - константа диссоциации слабого электролита, образующего соль, взятая по последней ступени (см. приложение).
Константа гидролиза Кг показывает отношение ионного произведения воды к константе того слабого электролита (слабой кислоты или слабого основания), по иону которого протекает гидролиз.
Чем слабее кислота или основание, образующие соль, тем больше константа гидролиза соли.
ПРИМЕР 9.Рассчитать константу гидролиза карбоната калия по первой ступени. Написать уравнение гидролиза этой соли по первой ступени.
РЕШЕНИЕ. Карбонат калия К2СО3, образован сильным основанием КОН и слабой кислотой Н2СО3. Следовательно, с водой будет взаимодействовать карбонат ион.
К2СО3↔ 2К+ + СО32-
СО32- + НОН ↔ НСО3- + ОН-
Константу гидролиза рассчитаем по формуле (13), зная, что КВ = 10-14, а К//Д (Н2СО3) = 4,8∙10-11 (см. приложение).
Кг = 10-14 / 4,8∙10-11 = 2∙10-4.
ОТВЕТ: Кг = 2∙10-4.
Степень и константа гидролиза связаны между собой соотношением:
Кг = β2∙С0 / 1 – β (14),
где С0 – молярная концентрация раствора (моль/л).
Этой формулой следует пользоваться, если соль образована слабой кислотой и слабым основанием. Для солей, образованных слабым основанием и сильной кислотой или слабой кислотой и сильным основанием справедливо приближенное соотношение, когда β«1:
Кг ≈ β2∙С0 (15)
или
β = 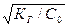 (16)
(16)
Это соотношение позволяет количественно оценить степень гидролиза в растворах солей определенной концентрации.
ПРИМЕР 10.Рассчитать степень гидролиза в 0,1М растворе хлорида аммония.
РЕШЕНИЕ. Найдем константу гидролиза по формуле (13), зная, что КВ = 10-14, а КД(NH4OH) = 1,79∙10-5(см.приложение).
Кг = КВ / КД = 10-14 / 1,79∙10-5 = 5,5∙10-10.
Так как соль образована сильной кислотой и слабым основанием, то из формулы (16) выразим β:
β = 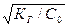 =
= 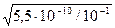 = 7,4∙10-5
= 7,4∙10-5
ОТВЕТ: β = 7,4∙10-5 или = 7,4∙10-3 %.
ПРИМЕР 11.Определить рН 0,1 М раствора фосфата калия.
РЕШЕНИЕ. Будем считать, что гидролиз практически протекает по первой ступени:
К3РО4 + Н2О ↔ К2НРО4 + КОН
РО43- + Н2О ↔ НРО42- + ОН-
Константа гидролиза по первой ступени определяется константой диссоциации образовавшейся слабой кислоты НРО42-, т.е. третьей константой диссоциации фосфорной кислоты, значение которой берем из приложения. Кд///(Н3РО4) = 1,3∙10-12.
Используя формулу (13), рассчитаем константу гидролиза:
Кг = КВ/КД = 10-14/(1,3∙10-12) = 7,7∙10-3.
Найдем степень гидролиза по формуле (16): β = √Кг/С0 = √7,7∙10-3/0,1 = 2,8∙10-2.
Определим концентрацию образовавшихся ОН- - ионов:
[OH-] = β∙С0; [OH-] = 2,8∙10-2∙0,1 = 2,8∙10-3, откуда рОН = - lg [OH-] =
= -lg (2,8∙10-3) = 2,55.
рН = 14 – рОН = 14 – 2, 55 = 11,45.
ОТВЕТ: рН = 11,45.
Лабораторная работа № 1
ХОД РАБОТЫ
Опыт 1. Экспериментальное наблюдение электропроводности водных растворов веществ.
В стакан с дистиллированной водой опустить угольные электроды, укреплённые на деревянной дощечке и подключенные в цепь последовательно с милливольтметром. Включите прибор в сеть. Отклоняется ли стрелка милливольтметра? Проводит ли дистиллированная вода электрический ток?
Таким же образом изучить электропроводность раствора сахара, 0,1н. растворов H2SO4, KOH, NH4OH, CH3COOН. Обратите внимание, отклоняется ли стрелка милливольтметра и на сколько сильно это отклонение.
Смешайте растворы NH4OH и CH3COOН. Изучите их электропроводность.
Какие из испытанных веществ являются электролитами? По глубине отклонения стрелки милливольтметра отметьте сильные и слабые электролиты. Чем можно объяснить разные показания милливольтметра для растворов NH4OH, CH3COOН и их смеси? К сильным или слабым электролитам относится продукт, полученный при смешивании растворов NH4OH и CH3COOН?
Оформите полученные данные в таблицу.
| Вещество | Уравнения диссоциации | Показания милливольтметра |
Составьте уравнения (в молекулярной и ионно-молекулярной формах) реакции, протекающей между NH4OH и CH3COOН при смешивании их растворов.
Сделайте общий вывод: сильными или слабыми электролитами являются кислоты? основания? соли? Чем измеряется сила электролита? Укажите условные значения степени и константы диссоциации для сильных, слабых и средней силы электролитов.
Опыт 2. Направление обменных ионных процессов в растворах электролитов.
