Термодинамические процессы, циклы
Примеры решения задач
20.Азот массой 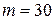 г занимает объем
г занимает объем 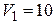 л и находиться под давлением
л и находиться под давлением 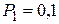 0 МПа. Сначала этот газ нагревается при неизменном давлении до объема
0 МПа. Сначала этот газ нагревается при неизменном давлении до объема 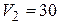 л, а затем при постоянном объеме до давления
л, а затем при постоянном объеме до давления 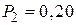 МПа. Найти:
МПа. Найти:
а) изменение 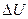 внутренней энергии газа;
внутренней энергии газа;
б) совершенную системой работу 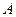 ;
;
в) количество теплоты  , переданной газу;
, переданной газу;
г) конечную температуру 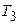 .
.
Построить график процесса на P – V-диаграмме.
Дано: 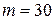 г г 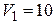 л л 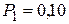 МПа МПа 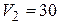 л л 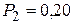 МПа МПа 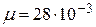 кг/моль кг/моль | Решение Анализ условия задачи начнём с построения графика процесса на P – V-диаграмме, учитывая соотношения величин 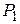 , , 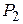 , , 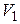 , , 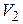 . . 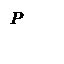  | |
а) 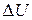 – ? б) – ? б) 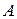 – ? в) – ? в) 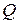 – ? г) – ? г) 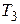 – ? – ? | ||
Как видно из рисунка, система из состояния 1 переходит в конечное состояние 3 сначала по изобаре 1 – 2, а затем по изохоре 2 – 3. Из графика следует, что работа 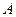 , совершенная газом в этом процессе, равна площади прямоугольника под изобарой 1 – 2, т. е.
, совершенная газом в этом процессе, равна площади прямоугольника под изобарой 1 – 2, т. е.
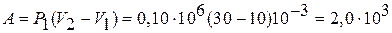 Дж.
Дж.
Для определения изменения внутренней энергии газа в рассматриеваемом процессе 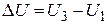 используем уравнение Клапейрона – Менделеева
используем уравнение Клапейрона – Менделеева
pV = 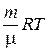 (1)
(1)
и выражение для внутренней энергии двухатомного идеального газа:
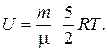 (2)
(2)
Из уравнений (1) и (2) для 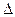 U следует
U следует
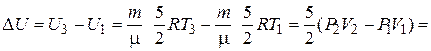
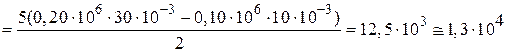 Дж.
Дж.
Из первого закона термодинамики для количества теплоты  , переданного газу, получается:
, переданного газу, получается:
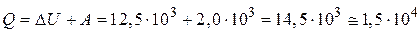 Дж.
Дж.
Из уравнения Клапейрона – Менделеева (1) для конечной температуры газа Т3 имеем:
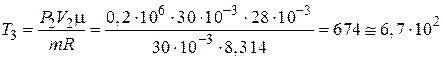 К.
К.
Ответ: 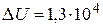 Дж;
Дж; 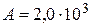 Дж;
Дж; 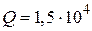 Дж;
Дж; 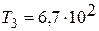 К.
К.
21.Одноатомный газ, имевший при давлении 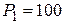 кПа объем
кПа объем 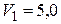 м3, сжимался изобарически до объема
м3, сжимался изобарически до объема 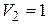 ,0 м3 , затем – адиабатически сжимался и на последнем участке цикла, расширялся при постоянной температуре до начального объема и давления. Найти теплоту
,0 м3 , затем – адиабатически сжимался и на последнем участке цикла, расширялся при постоянной температуре до начального объема и давления. Найти теплоту 
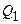 , полученную газом от нагревателя, теплоту
, полученную газом от нагревателя, теплоту 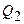 , переданную газом холодильнику, работу
, переданную газом холодильнику, работу 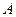 , совершенную газом за весь цикл, КПД цикла
, совершенную газом за весь цикл, КПД цикла 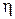 . Изобразить цикл на P – V-диаграмме.
. Изобразить цикл на P – V-диаграмме.
Дано: 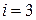 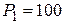 кПа кПа 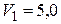 м3 м3 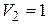 ,0 м3 ,0 м3 | Решение Анализ условия задачи начнём с построения графика цикла на P – V-диаграмме, учитывая соотношения величин 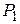 , , 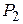 , , 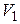 , , 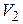 , , 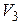 . .   | |
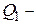 ? ? 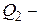 ? ? 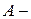 ? ? 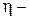 ? ? | ||
Как видно из рисунка, на первом участке цикла 1 – 2 газ сжимался изобарически, отдавая холодильнику количество теплоты 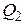 и совершая работу
и совершая работу 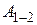 . По первому закону термодинамики для перехода из состояния 1 в состояние 2 можно записать:
. По первому закону термодинамики для перехода из состояния 1 в состояние 2 можно записать:
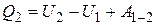 , (1)
, (1)
где 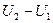 – изменения внутренней энергии газа. Выражение для внутренней энергии одноатомного газа имеет вид:
– изменения внутренней энергии газа. Выражение для внутренней энергии одноатомного газа имеет вид:
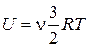 , (2)
, (2)
где 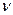 – количество вещества, а уравнение Клапейрона – Менделеева:
– количество вещества, а уравнение Клапейрона – Менделеева:
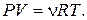 (3)
(3)
Используем уравнения (2), (3) и тот факт, что работа газа на участке 1 – 2 равна площади прямоугольника (с обратным знаком) под изобарой 1 – 2, для количества теплоты 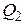 из соотношения (1) получим
из соотношения (1) получим
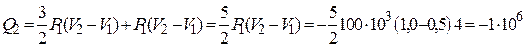 Дж.
Дж.
Знак “минус” показывает, что количество теплоты 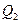 отдаётся газом холодильнику.
отдаётся газом холодильнику.
Количество теплоты 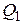 , которое получает газ от нагревателя на изотерме 3 – 1 при температуре
, которое получает газ от нагревателя на изотерме 3 – 1 при температуре 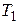 , по первому закону термодинамики равно:
, по первому закону термодинамики равно:
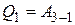 , (4)
, (4)
где 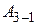 – работа, совершённая газом на участке 3 – 1.
– работа, совершённая газом на участке 3 – 1.
Как известно, работа газа при изотермическом процессе определяется формулой
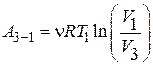 . (5)
. (5)
Состояния (3) и (1) находятся на одной изотерме, поэтому
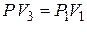 . (6)
. (6)
В то же время состояния (3) и (2), как видно из рисунка, соответствует одной адиабате, поэтому из уравнения Пуассона следует
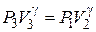 (7)
(7)
где 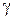 – показатель адиабаты одноатомного идеального газа
– показатель адиабаты одноатомного идеального газа 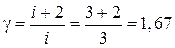 . Исключая из уравнений (6) и (7) величины давления
. Исключая из уравнений (6) и (7) величины давления 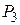 и
и 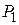 , получим
, получим 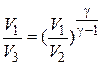 (8)
(8)
Используя формулы (3), (5) и (8) для количества теплоты 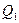 из соотношения (4) имеем
из соотношения (4) имеем
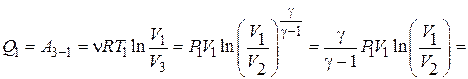
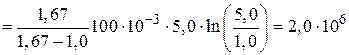 Дж.
Дж.
Работа 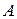 , совершённая газом за цикл, как вытекает из первого закона термодинамики,
, совершённая газом за цикл, как вытекает из первого закона термодинамики, 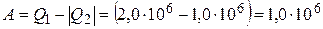 Дж.
Дж.
Для КПД цикла 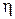 имеем:
имеем: 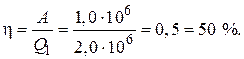
Ответ: 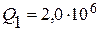 Дж;
Дж; 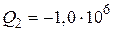 Дж;
Дж; 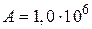 Дж;
Дж; 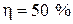
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
2.20. Молекулярный кислород массой m = 250 г, имевший температуру Т1 = 200 К, был адиабатно сжат. При этом была совершена работа А = 25 кДж. Определить конечную температуру Т2 газа.
(354 K)
2.21. Газ адиабатически расширяется, изменяя объем в 2 раза, а давление в 2,64 раза. Определить молярные теплоемкости Cp и Cv этого газа.
(Cp = 29,1 Дж/(моль×К), Cv = 20,8 Дж/(моль×К))
2.22. Некоторое количество азота n, имеющего параметры состояния p1, V1, T1, переходит при постоянной температуре в состояние 2, а затем при постоянном объеме – в состояние 3. Определить работу перехода 1 – 3, изменение внутренней энергии газа и теплоту, полученную при переходах, если в конце процесса установилась температура T3 и давление p3 = p1. Изобразить процесс 1 – 3 на диаграмме V-T.
(A1-3 = nRT1ln(T3/T1); DU1-3 = (5/2)nR(T3 – T1);
Q = nR[(5/2)(T3-T1)+T1ln(T3/T1)])
2.23. Азот плотностью r1 = 1,4 кг/м3 занимает объем V1 = 5 л при температуре t1 = 27 °C. Газ адиабатически переведен в состояние с плотностью r = 3,5 кг/м3. Определить температуру газа T2 в конце перехода и изменение его внутренней энергии. Построить переход на диаграмме S – T.
(T2 = 433 К; DU = 691 Дж)
2.24. Нагревается или охлаждается идеальный газ, если он расширяется по закону р1/2×V = const? Изобразите этот закон на диаграмме (V – T). Считая этот процесс политропическим, определить, чему равен показатель политропы h. При расширении газа тепло подводится к нему или отводится от него? Сравнить теплоёмкость С этого процесса с СV.
(СV > С)
2.25. Нагревается или охлаждается идеальный газ, если он расширяется по закону р2V = const? Изобразите этот закон на диаграмме (р-Т). Считая этот процесс политропическим, определить чему равен показатель политропы h. При расширении газа тепло подводится к нему или отводится от него? Сравнить теплоёмкость С этого процесса с СV.
η = 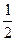 ; С>Сv)
; С>Сv)
2.26. В сосуде вместимостью V = 10 л находится идеальный газ под давлением p1 = 1,0×105 Па. Стенки сосуда могут выдержать максимальное давление p2 = 1,0×106 Па. Какое максимальное количество тепла Q можно сообщить газу? Постоянная адиабаты g = 1,4.
(Q = 23 кДж)
2.27. Некоторую массу азота сжали в 5 раз (по объёму) двумя разными способами: один раз изотермически, другой раз адиабатически. Начальное состояние газа в обоих случаях одинаково. Найти отношение соответствующих работ, затраченных на сжатие газа. Изобразить процессы в координатах P – V и Т – S.
(AТ/AА = 0,712)
2.28. В бензиновом автомобильном двигателе степень сжатия горючей смеси равна 6,2. Смесь засасывается в цилиндр при температуре t1 = 15 °C. Найти температуру t2 горючей смеси к концу такта сжатия. Горючую смесь рассматривать как двухатомный идеальный газ, процесс считать адиабатным.
(324 °С)
2.29. Тепловая машина работает по циклу Карно, КПД которого h = 0,25. Каков будет холодильный коэффициент k 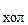 машины, если она будет совершать тот же цикл в обратном направлении? Холодильным коэффициентом называется отношение количества теплоты, отнятого от охлаждаемого тела, к работе двигателя, приводящего в движение машину.
машины, если она будет совершать тот же цикл в обратном направлении? Холодильным коэффициентом называется отношение количества теплоты, отнятого от охлаждаемого тела, к работе двигателя, приводящего в движение машину.
(k 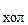 = 3)
= 3)
2.30. Один моль одноатомного идеального газа совершает тепловой цикл Карно между тепловыми резервуарами с температурами t1 = 127 °С и t2 = 27 °С. Наименьший объем газа в ходе цикла V1 = 5,0 л, наибольший V3 = 20 л. Какую работу А совершает эта машина за один цикл? Сколько тепла Q1 берет она от высокотемпературного резервуара за один цикл? Сколько тепла Q2 поступает за цикл в низкотемпературный резервуар?
(Q1 = 3,2×103 Дж; Q2 = 2,4×103 Дж; A = 8,1×102 Дж)
2.31.Трехатомный идеальный газ с жесткой связью между молекуламисовершает цикл Карно, при этом в процессе адиабатного расширения объем газа увеличивается в 4 раза. Определите термический КПД цикла.
( 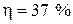 )
)
2.32. Найти КПД цикла, состоящего из двух изохор и двух изотерм, если в пределах цикла объём изменяется в k раз, а абсолютная температура в t раз. Рабочим веществом является идеальный газ с показателем адиабаты g.
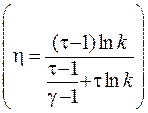
Энтропия
Пример решения задачи
22. При нагревании двухатомного идеального газа ( 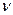 = 2 моля) его термодинамическая температура увеличилась в 2 раза (n = 2). Определите изменение энтропии, если нагревание происходит: 1)изохорно; 2) изобарно.
= 2 моля) его термодинамическая температура увеличилась в 2 раза (n = 2). Определите изменение энтропии, если нагревание происходит: 1)изохорно; 2) изобарно.
Дано: i = 5 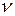 = 2,0 моля = 2,0 моля 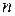 = = 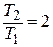 1) V = const 2) p = const 1) V = const 2) p = const | Решение 1)V = const. Из определения энтропии 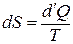 . Изменение энтропии . Изменение энтропии  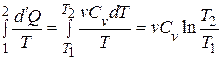 , где , где 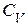 – молярная теплоёмкость при постоянном давлении. Так как – молярная теплоёмкость при постоянном давлении. Так как 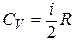 , то , то 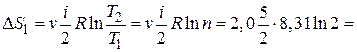 = 28,8 Дж/К = 28,8 Дж/К 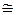 29 Дж/К 29 Дж/К |
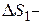 ? ? 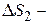 ? ? |
2) р = const.
Учитывая что 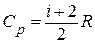 , где
, где 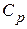 – молярная теплоёмкость при постоянном давлении аналогично п. 1 получим:
– молярная теплоёмкость при постоянном давлении аналогично п. 1 получим:
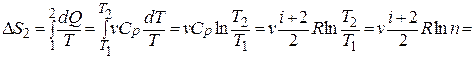
= 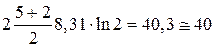 Дж/К.
Дж/К.
Ответ: 1)  29 Дж/К; 2)
29 Дж/К; 2) 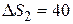 Дж/К.
Дж/К.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
2.33. Какое количество тепла Q нужно сообщить 75 г водяных паров, чтобы нагреть их от 100 С до 250 °С при постоянном давлении? Определите изменение энтропии водяного пара.
(Q = 20,8 кДж; DS = 47,5 Дж/К)
2.34. Определить изменение DS энтропии при изотермическом расширении кислорода массой m = 10 г от объема V1 = 25 л до объема V2 = 100 л. (Относительная молекулярная масса кислорода 32).
(3,6 Дж/К)
2.35. Найти изменение DS энтропии при нагревании воды массой m = 100 г от температуры t1 = 0 °C до температуры t2 = 100 °C и последующим превращении воды в пар той же температуры. Удельная теплоемкость воды C = 4,18 кДж/(кг×К), удельная теплота парообразования воды 2,25×103 кДж/кг.
(737Дж/К)
2.36. Найти изменение DS энтропии при превращении массы m = 200 г льда, находившегося при температуре t1 = -10,7 °C в воду при t2 = 0 °C.
Теплоемкость льда считать не зависящей от температуры. С = 2,1×103 Дж/(кг×К). Температуру плавления принять равной 273 К.Удельная теплота плавления льда l = 333×103 Дж/кг.
(DS = m[C×ln(T2/T1)+l/T2] = 261 Дж/К)
2.37. Один киломоль газа изобарически нагревается от 20 до 600 °С, при этом газ поглощает 1,20×107 Дж тепла. Найти число степеней свободы молекулы газа i; построить зависимость энтропии S как функцию от температуры Т газа.
(i = 3)
