При постоянном давлении и объёме
ПУТЕЙ СООБЩЕНИЯ (МИИТ)
Кафедра «Физика»
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЁМКОСТЕЙ
ВОЗДУХА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ОБЪЁМЕ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К ЛАБОРАТОРНОЙ РАБОТЕ № 144
по дисциплине «Физика»
Под редакцией профессора Марченко В.И.
МОСКВА – 2011
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ПУТЕЙ СООБЩЕНИЯ (МИИТ)
Кафедра «Физика»
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЁМКОСТЕЙ
ВОЗДУХА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ОБЪЁМЕ
Под редакцией профессора В.И. Марченко
Рекомендовано редакционно-издательским советом
университета в качестве методических указаний для студентов ИУИТ, ИТТСУ и ИПСС
 МОСКВА -2011
МОСКВА -2011
 УДК 531.53
УДК 531.53
Л-90
Р.М. Лагидзе, Ю.Н. Харитонов, А.М. Куюмчян. Определение отношения теплоёмкостей воздуха при постоянном давлении и объёме. Методические указания к лабораторной работе № 144 по дисциплине «Физика» / под ред. проф. В.И. Марченко – М.: МИИТ, 2011. – 13 с.
Методические указания к выполнению лабораторной работы № 144 «Определение отношения теплоёмкостей воздуха при постоянном давлении и объёме» соответствуют программе и учебным планам по физике (раздел «Молекулярная физика») и предназначены для студентов 1, 2 курсов технических специальностей.
© Московский государственный
университет путей сообщения
(МИИТ), 2011
Работа 144
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЁМКОСТЕЙ ВОЗДУХА
ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ОБЪЁМЕ
Цель работы: Определение отношения теплоёмкости воздуха при постоянном давлении к теплоёмкости при постоянном объёме.
Приборы и принадлежности: установка ФПТ1-6, общий вид которой приведён на рис. 3.
Введение
Удельной теплоемкостью вещества называется величина, равная количеству теплоты, которую необходимо сообщить единице массы вещества для увеличения её температуры на один Кельвин:
с = 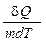 .
.
Молярной теплоёмкостью (или теплоёмкостью одного моля вещества) называется величина, равная количеству теплоты, которую необходимо сообщить одному молю вещества для увеличения его температуры на один Кельвин:
C = cμ = 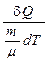 =
= 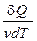 ,
,
где m – масса; m – масса одного моля вещества, n = 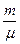 – число молей.
– число молей.
В СИ удельная теплоёмкость выражается в Дж/кг∙К, а молярная – в Дж/моль∙К.
Численное значение теплоёмкости зависит от природы газа и процесса нагревания.
Согласно первому закону термодинамики количество теплоты δQ, сообщенное системе, расходуется на увеличение внутренней энергии dU и на выполнение системой работы δA против внешних сил:
δQ = dU + δA. (1)
Увеличение внутренней энергии идеального газа при увеличении его температуры на dT:
dU = 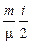 RdT, (2)
RdT, (2)
где i – число степеней свободы молекулы, под которым подразумевается число независимых координат, определяющих положение молекулы в пространстве: i = 3 – для одноатомных; i = 5 – для двухатомных; i = 6 – для трёх- и многоатомных молекул; R – универсальная газовая постоянная; R =8,31 Дж/(моль·К).
При расширении газа он выполняет работу: 
δA = PdV.
Если газ нагревать при постоянном объёме V = const, то δА = 0, и согласно (1) все полученное газом количество теплоты расходуется только на увеличение его внутренней энергии (dQV = dU), и, учитывая (2), молярная теплоемкость идеального газа при постоянном объеме:
CV = 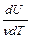 = (i/2)R.
= (i/2)R.
Если газ нагревать при постоянном давлении P = const, то полученное газом количество теплоты расходуется на увеличение внутренней энергии dU и выполнение работы δА:
δQ =dU+PdV.
Тогда молярная теплоемкость идеального газа при постоянном давлении:
CP = 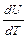 +
+ 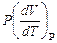 .
.
Используя уравнение состояния идеального газа (уравнение Клапейрона – Менделеева),
PV = 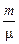 RT,
RT,
можно доказать, что для одного моля газа
P 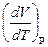 = R,
= R,
и поэтому молярная теплоемкость при P = const:
CP = 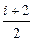 R.
R.
Для отношения теплоёмкостей g можно записать:
g = 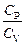 =
= 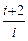 . (3)
. (3)
Методика измерений
Для определения отношения СР/CV для воздуха в данной лабораторной работе применен метод, предложенный Клеманом и Дезормом, в котором использовано охлаждение газа при его адиабатическом расширении. Предполагается, что воздух – идеальный газ.
Адиабатическим называется процесс, который происходит без теплообмена с окружающей средой. Быстрое сжатие и быстрое расширение газа приблизительно можно рассматривать как адиабатический процесс.
Согласно первому закону термодинамики (1) для адиабатического процесса:
0 = dU + δA.
Откуда δA = -dU = - 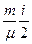 RdT.
RdT.
Из последнего уравнения видно, что при адиабатическом сжатии температура газа повышается за счёт работы внешних сил (δA<0), а при адиабатическом расширении (δA>0) температура газа понижается, т.к. часть внутренней энергии газа расходуется на работу по расширению газа.
Рисунки 1 и 2 поясняют метод Клемана и Дезорма.
На рисунке 1 изображён лабораторный стенд, который состоит из стеклянного баллона Б, наполнённого воздухом и соединённого с водяным манометром М. Посредством крана К баллон может сообщаться с атмосферой. Первоначально в баллоне было атмосферное давление РА и температура TА, равная температуре окружающей среды.
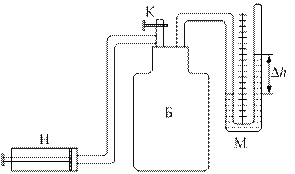
Рис. 1
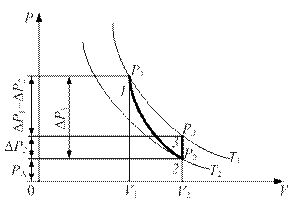
Рис. 2
Если с помощью насоса Н подкачать в баллон некоторое количество воздуха, то давление в баллоне повысится до значения Р1. Манометрический водяной столбик не сразу займет окончательное положение, так как при быстром сжатии температура повышается. Благодаря теплопроводности стенок сосуда через некоторое время температура воздуха в баллоне сравняется с температурой воздуха окружающей среды. Это состояние газа характеризуется температурой Т1 = ТА, и давлением Р1 (на рис. 2 точка 1). Давление Р1 равно сумме первоначального давления газа в баллоне РА и избыточного давления газа в баллоне DР1:
Р1 = РА + DР1.
После того как давление газа в баллоне установилось, открывается кран и воздух адиабатически расширяется, выходя в атмосферу. В тот момент, когда давление воздуха в баллоне становится равным атмосферному (высота столбиков воды в обоих коленах манометра сравнивается), кран быстро закрывается. При расширении температура газа в баллоне понижается. Это состояние представлено точкой 2 на рис. 2. В первоначальный момент температура ниже ТА окружающей среды. Через некоторое время после закрытия крана температура воздуха в баллоне повышается до температуры ТА за счет теплообмена с окружающей средой, а давление в баллоне при этом повысится на величину избыточного давления DР2.
Состояние газа будет характеризоваться температурой Т1 и давлением:
Р3 = РА + DР2.
Это состояние представлено точкой 3 на рис. 2. Таким образом, процесс перехода газа из состояния 1 в состояние 2 происходит адиабатически, а из состояния 2 в состояние 3 изохорически. Точки 1 и 3 диаграммы лежат на одной изотерме. Адиабатическое расширение при переходе из состояния 1 в состояние 2 описывается уравнением Пуассона:
Р1 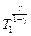 = Р2
= Р2 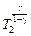 .(4)
.(4)
Для изохорического процесса при переходе газа из состояния 2 в состояние 3 имеем:
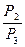 =
= 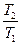 . (5)
. (5)
Из уравнений (4) и (5), исключив T2/T1, получим:
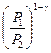 =
= 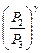 (6)
(6)
Логарифмируя выражение (6), получим:
(1 - g) (lgP1 - lgP2) = g(lgP2 - lgP3).
откуда
g = 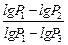 .
.
Заменив Р1, Р2 и Р3 на Р1 = РА + DР1, Р2 = РА, Р3 = РА + DР2,
получим:
g = 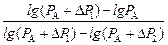 .
.
Учитывая, что Dlgx » Dх/х, если Dх малая по сравнению с х величина, имеем (DР1 и DР2 малы по сравнению с РА):
g = 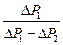 .
.
Учитывая также, что DР = rgDh, где Dh - разница высот столбиков воды в манометре, окончательно получаем:
g = 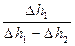 . (7)
. (7)
