Сравнительная характеристика аморфных и кристаллических веществ
СТРОЕНИЕ И СВОЙСТВО ТВЕРДОГО ВЕЩЕСТВА
Теоретические сведения
Вещество может существовать в трех агрегатных состояниях: газообразном, жидком и твердом. Плазму часто называют четвертым агрегатным состоянием. Зависимость свойств вещества от агрегатного состояния указана в табл. 33.
Таблица 1
Свойства веществ в разных агрегатных состояниях
| Состояние | Свойство |
| Газообразное | 1. Способность принимать объем и форму сосуда 2. Сжимаемость 3. Быстрая диффузия (хаотичное движение молекул) 4. Екинетич. > Епотенц. |
| Жидкое | 1. Способность принимать форму той части сосуда, которую занимает вещество 2. Неспособность расширяться до заполнения сосуда 3. Незначительная сжимаемость 4. Медленная диффузия 5. Текучесть 6. Екинетич. = Епотенц. |
| Твердое | 1. Способность сохранять свойственную форму и объем 2. Незначительная сжимаемость (под давлением) 3. Очень медленная диффузия за счет колебательных движений частиц 4. Отсутствие текучести 5. Екинетич. < Епотенц. |
Агрегатное состояние вещества определяется силами, действующими между молекулами, расстоянием между частицами и характером их движения.
В твердом состоянии частицы занимают определенное положение относительно друг друга. Вещество обладает низкой сжимаемостью, механической прочностью, поскольку молекулы не имеют свободы движения, а только колебания. Молекулы, атомы или ионы, образующие твердое вещество, называют структурными единицами.
Твердые вещества делятся на аморфные и кристаллические
(табл. 34). Кристаллические вещества плавятся при строго определенной температуре Тпл, аморфные – не имеют резко выраженной температуры плавления; при нагревании они размягчаются (характеризуются интервалом размягчения) и переходят в жидкое или вязкотекучее состояние рис. 18.
Таблица 2
Сравнительная характеристика аморфных и кристаллических веществ
| Вещество | Характеристика |
| Аморфное | 1. Ближний порядок расположения частиц 2. Изотропность физических свойств 3. Отсутствие конкретной точки плавления 4. Термодинамическая нестабильность (большой запас внутренней энергии) 5. Текучесть Примеры: янтарь, стекло, органические полимеры и др. |
| Кристаллическое | 1. Дальний порядок расположения частиц 2. Анизотропность физических свойств 3. Конкретная температура плавления 4. Термодинамическая устойчивость (малый запас внутренней энергии) 5. Есть элементы симметрии Примеры: металлы, сплавы, твердые соли, углерод (алмаз, графит) и др. |
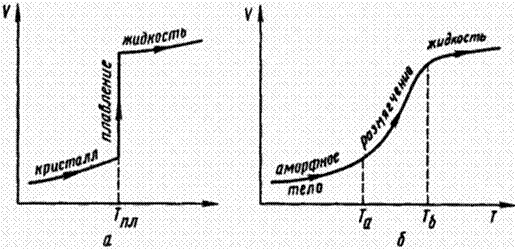
Рис. 18. Изменение объема веществ при нагревании: а – кристаллических; б – аморфных
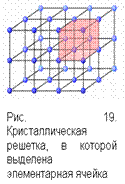 | Внутреннее строение аморфных веществ характеризуется беспорядочным расположением молекул(табл. 34). Кристаллическое состояние вещества предполагает правильное расположение в пространстве частиц, составляющих кристалл, и образованиемкристаллической (пространственной) решетки Основной особенностью кристаллических тел является их анизотропия – неодинаковость свойств (тепло-, электропроводность, механическая прочность, скорость растворения и т. д.) по разным направлениям, в то время как аморфные тела – изотропны. Твердые кристаллы – трехмерные образования, характеризующиеся строгой повторяемостью одного и того же элемента структуры (элементарной ячейки) во всех направлениях. Элементарная ячейка представляет собой наименьший объем кристалла в виде параллелепипеда, повторяющегося в кристалле бесконечное число раз. Задают элементарную ячейку с помощью осей и углов (рис. 19). |
Существуют основные параметры кристаллических решеток.
Энергия кристаллической решетки Екр., кДж/моль, –это энергия, которая выделяется при образовании 1 моля кристалла из микрочастиц (атомы, молекулы, ионы), находящихся в газообразном состоянии и удаленных друг от друга на расстояние, исключающее их взаимодействие.
Константа кристаллической решетки d, [A0] –наименьшее расстояние между центром двух частиц в кристалле, соединенных химической связью.
Координационное число к.ч. –число частиц, окружающих в пространстве центральную частицу, связанных с ней химической связью.
Точки, в которых размещены частицы кристалла, называются узлами кристаллической решетки
Несмотря на многообразие форм кристаллов, их можно строго и однозначно классифицировать. Систематизация форм кристаллов была введена русским академиком А.В. Гадолиным (1867), она основана на особенностях симметрии кристаллов. В соответствии с геометрической формой кристаллов возможны следующие их системы (сингонии): кубическая, тетрагональная, орторомбическая, моноклинная, триклинная, гексагональная и ромбоэдрическая (рис. 20).
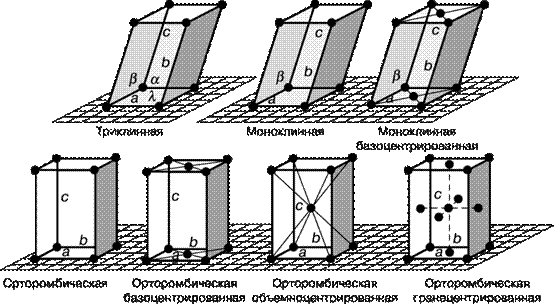
Рис. 20. Основные системы кристаллов
Одно и то же вещество может иметь различные кристаллические формы, которые отличаются по внутреннему строению, а значит, и по физико-химическим свойствам. Такое явление называется полиморфизмом. Изоморфизм –два разных по природе вещества образуют кристаллы одинаковой структуры. Такие вещества могут замещать друг друга в кристаллической решетке, образуя смешанные кристаллы.
В зависимости от вида частиц, находящихся в узлах кристаллической решетки и типа связей между ними кристаллы бывают четырех типов: молекулярные, атомные, ионные и металлические (рис. 21).
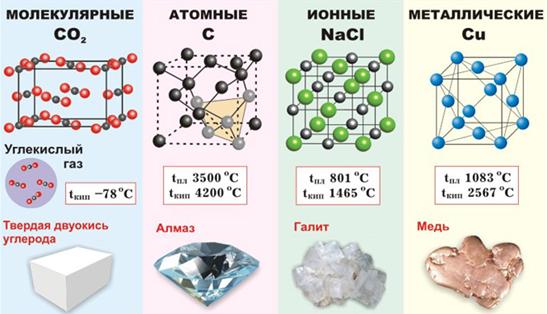
Рис. 21. Виды кристаллов
Кристаллические решетки, состоящие из молекул (полярных и неполярных) называются молекулярными. Молекулы в таких кристаллических решетках соединены между собой сравнительно слабыми водородными, межмолекулярными и электростатическими силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления. Они малорастворимы в воде, не проводят электрический ток и обладают высокой летучестью. Примерами веществ с молекулярными решетками являются лед, твердый углекислый газ («сухой лед»), твердые галогенводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Cl2, Br2, J2, H2, N2,O2), трех- (O3), четырех- (P4), восьми- (S8) атомными молекулами. Большинство кристаллических органических соединений также имеют молекулярную решетку.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называют атомными (ковалентными). Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером кристалла с атомной кристаллической решеткой может служить алмаз (рис. 21) – одна из модификаций углерода. Данный кристалл состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами (к.ч. = 4).
Число веществ с атомной кристаллической решеткой велико. Все они имеют высокую температуру плавления, не растворимы в жидкостях, обладают высокой прочностью, твердостью, имеют широкий диапазон электропроводимости (от изоляторов и полупроводников до электронных проводников). Атомная кристаллическая решетка характерна для элементов III и IV групп главных подгрупп (Si, Ge, B, C).
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером образования ионной кристаллической решетки может служить кристалл хлорида натрия (NaCl) (рис. 21). Вещества с ионной кристаллической решеткой обладают высокой твердостью, хрупкостью, являются тугоплавкими и малолетучими. Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и ослаблению прочности связи между ними. Поэтому расплавы, растворы таких кристаллов проводят электрический ток. Вещества с ионными кристаллическими решетками легко растворяются в полярных жидкостях, являются диэлектриками. Ионные кристаллические решетки образуют многие соли, оксиды, основания.
Кристаллическая решетка, состоящая из атомов и ионов металлов, соединенных металлической связью (рис. 21), называется металлической.
Металлическая решетка является, как правило, весьма прочной. Этим объясняются свойственные большинству металлов твердость, малая летучесть, высокая температура плавления и кипения. Она же обусловливает такие характерные свойства металлов как электро- и теплопроводность, блеск, ковкость, пластичность, непрозрачность, фотоэффект. Металлической кристаллической решеткой обладают чистые металлы и сплавы.
