Nbsp; Е, кДж/моль
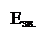 |  |  | |||

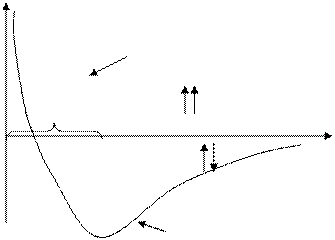 |
Рис.5. Залежність енергії взаємодії системи з двох атомів Гідрогену від відстані
між їхніми ядрами.
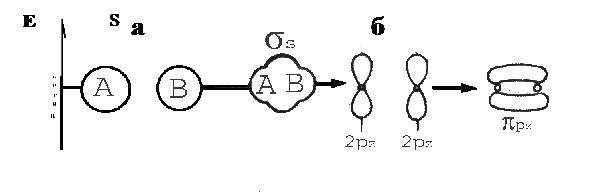 |
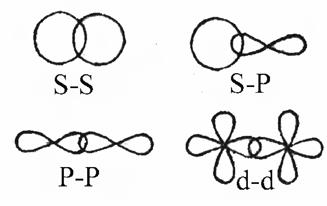
Розподіл енергії електронів на молекулярних орбіталях у просторі розраховують шляхом складання лінійних комбінацій атомних орбіталей (ЛКАО). На рис.6 наведені схеми утворення зв’язуючих молекулярних орбіталей з двох s- (а) та двох p-орбіталей (б):
Рис.6. Схеми утворення зв’язуючих молекулярних орбіталей.
Механізм утворення ковалентного зв’язку шляхом усуспільнення неспа-рених електронів двох атомів дістав назву обмінного механізму.
Можливий також інший механізм — донорно-акцепторний або координаційний. У цьому випадку один атом або іон повинен мати неподілену електронну пару, а інший атом або іон мусить мати вакантну, тобто вільну, атомну орбіталь. Атом або іон, що надає пару електронів, називають донором, а атом або іон, до якого ця пара електронів переміщується — акцептором.
 |
Розглянемо утворення хімічного зв’язку за донорно-акцепторним меха-нізмом при взаємодії молекули амоніаку з іоном Гідрогену (NH3 з Н+). Атом Нітрогену має на зовнішньому енергетичному рівні два спарених електрони
 |
У молекулі амоніаку неспарені електрони атома Нітрогену утворюють три електронні пари з електронами атомів Гідрогену. Атомна орбіталь іона Гідрогену не містить електронів (вакантна орбіталь). При зближенні молекули амоніаку та іону Гідрогену відбувається взаємодія неподіленої пари електронів Нітрогену і вакантної орбіталі іона Гідрогену:
 H H +
H H +
 ·· ··
·· ··
 H+ + : N : H H : N : H
H+ + : N : H H : N : H
1s ·· ··
H H
Виникає ковалентний зв’язок за донорно-акцепторним механізмом.
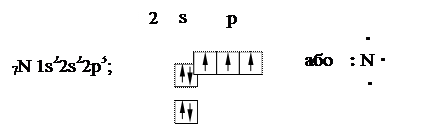
Вчення про хімічний зв’язок широко використовує поняття валентності. Валентність визначається кількістю орбіталей, які можуть брати участь в утво-ренні ковалентного зв’язку. Це можуть бути орбіталі вільні, ті, що мають неспа-рені електронні хмари, і ті, що мають неподілені двоелектронні хмари. Так, ва-лентність елементів I групи головної підгрупи дорівнює одиниці, оскільки на зовнішньому рівні вони мають один електрон …ns1. Валентність елементів го-ловної підгрупи II групи в нормальному (незбудженому) стані дорівнює нулю, оскільки на зовнішньому рівні немає неспарених електронів …ns2. При збуд-женні цих атомів один з двох s-електронів переходить на вільну 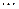 np-орбіталь. Такий збуджений атом має два електрони. Наприклад, в атома 4Be:
np-орбіталь. Такий збуджений атом має два електрони. Наприклад, в атома 4Be:
 |
Витрати енергії на роз’єднання спарених електронів і зміну напряму спі-ну одного з них перекриваються енергетичним виграшем при утворенні двох хі-мічних зв’язків.
Характеристика ковалентного зв’язку. Ковалентний зв’язок характеризується напрямленістю у просторі, насиченістю, кратністю, довжиною, енергією та полярністю.
Оскільки електронні хмари атомів мають певну просторову орієнтацію, зони перекривання просторових хмар знаходяться у певному напрямку відносно до атомів, що взаємодіють. Тому ковалентний зв’язок характеризується напрямленістю.
Насиченість зумовлена тим, що у хімічній взаємодії приймають участь електрони тільки зовнішніх енергетичних рівнів, тобто обмежена кількість електронів.
 |
Кратність визначається числом електронних пар, які зв’язують атоми. Виникнення стійкої електронної структури атомів відбувається при утворенні одинарних та кратних зв’язків: подвійного (CO2, H2C = CH2) або потрійного (N2, HC ≡ CH). У кратних зв’язках зв’язки нерівноцінні. Залежно від напрямлення перекриття атомних орбіталей розрізняють σ- та π-зв’язки. σ-зв’язок виникає при перектритті атомних орбіталей вздовж осі, що з’єднує ядра (рис.7)
Рис. 7. Перекриття різних електронних хмар при утворенні σ-зв’язку.
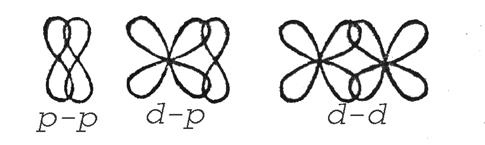 |
π-зв’язок здійснюється при перекритті атомних орбіталей по обидва боки осі, що поєднує ядра атомів (рис.8.).
Рис.8. Перекриття електронних хмар при утворенні π-зв’язку.
σ- і π-зв’язки розрізняються не тільки просторово, а й енергетично. Енергія π-зв’язку менша ніж енергія σ–зв’язку, тому міцність π–зв’язку значно поступається міцності σ–зв’язку. Внаслідок цього при хімічних реакціях π–зв’язки розриваються набагато легше, ніж σ–зв‘язки.
Підвищення кратності зв’язку призводить до зміцнення міжатомного зв’язку і зменшення міжатомної відстані (довжини зв’язку). Так, у сполуках С6Н6, С2Н4, С2Н2 енергії зв’язків Карбон-Карбон і їхня довжина дорівнюють:
С - С 348 кДж/моль 0.1543 нм (1 нм = 10-9м )
С = С 610 кДж/моль 0.1353 нм
С ≡ С 837 кДж/моль 0.1205 нм
Полярність зв’язкувиникає при зміщенні спільної електронної пари до атома елемента з більшою електронегативністю. Наприклад, у молекулі HCl атом Хлору набуває ефективного негативного заряду δCl = -0.17, а атом Гідрогену — позитивного заряду δH = 0.17. При утворенні ковалентного зв’язку між двома однаковими атомами (Н2, Сl2, F2 та ін.) усуспільнена двоелектронна хмара є симетричною відносно обох атомних центрів. Такий ковалентний зв’язок нази-вається неполярним.
Кількісною мірою полярності хімічного зв’язку є електричний момент диполя зв’язку Рзв. Електричним моментом диполя зв’язку називається добуток ефективного заряду d на відстань між центрами ваги позитивного й негативного зарядів lзв:
Pзв = δ ∙ lзв.
Іонний зв’язок. Іонний зв’язок можна розглядати як крайній випадок по-лярного ковалентного зв’язку. Він утворюється при взаємодії атомів, які дуже відрізняються значеннями електронегативностей. Це зумовлює майже повне зміщення електронної пари зв’язку до атома більш електронегативного еле-мента, в результаті чого утворюються електрично заряджені часточки — іони, які електростатично притягаються один до одного. Так, наприклад, при взаємодії атомів Натрію (ЕНNa = 0.93) з атомами Флуору (ЕНF = 4.10) відбуваються такі процеси:
Na – e ® Na+;
F + e ® F-; 
Na + F ® Na+ + F-
·· ··
aбо Na · + · F : ® Na+ + : F:¯.
∙∙ ∙∙
На відміну від ковалентного зв’язку, іонний зв’язок не має напрямленості, оскільки електричне поле іона має сферичну симетрію. Крім того, іонний зв’язок ненасичений, оскільки при взаємодії двох протилежно заряджених іонів не відбувається повної взаємної компенсації їхніх полів, вони зберігають здатність взаємодіяти з іншими іонами.
Ненасиченість іонного зв’язку найяскравіше виявляється у схильності сполук з цим зв’язком до утворення кристалічних решіток, у вузлах яких кожний іон оточений максимально можливим числом іонів протилежного заряду
(6 іонів Cl- навколо іона Na+ в кристалі NaCl або 8 іонів Cl- навколо іона Cs+ в кристалі CsCl). Тому формули NaCl, CsCl передають лише співвідношення між числами іонів у кристалічних решітках натрій хлориду і цезій xлориду.
Енергія зв’язку іонної сполуки, що знаходиться в твердому стані, характеризується енергією його кристалічних решіток, тобто енергією утворення 1 моля кристалу з ізольованих іонів, наприклад Na+ та F-. Tак, енергії кристалічних решіток становлять для NaF 905 кДж/моль, для NaJ 690 кДж/моль.
Металічний зв’язок. За звичайних умов метали (за винятком ртуті) існують у вигляді кристалів. Природа металічного зв’язку, що утримує атоми металів в єдиному кристалі, подібна до ковалентного зв’язку: обидва типи зв’язку засновані на усуспільненні валентних електронів. Але на відміну від ковалентного зв’язку металічний зв’язок сильно делокалізований, тобто не має певної напрямленості і здійснюється усуспільненими електронами, які переміщуються по всьому об’єму кристала. Це зумовлюється тим, що в атомах металів кількість валентних електронів значно менша за кількість валентних орбіталей. У кристалічних решітках валентні орбіталі сусідніх атомів перекриваються, завдяки чому електрони вільно переміщуються з однієї орбіталі на іншу і здійснюють зв’язок між усіма атомами кристала металу. До того ж невисокі енергії іонізації металів зумовлюють легкість відриву валентних електронів від атомів і переміщення їх по всьому об’єму кристала. Спрощено метал можна розглядати як гігантську молекулу, побудовану з катіонів та нейтральних атомів, зв’язаних між собою відносно вільними валентними електронами — електронним газом.
Енергетичною характеристикою металічного зв’язку є теплота сублімації, яка змінюється від 80 Дж/моль для Cs до 857 Дж/моль для W. Oсобливо міцний металічний зв’язок у важких перехідних металах, що зумовлює їхні високі температури плавлення та кипіння, механічну міцність.
Будова молекул.Структура молекул визначається не тільки якісним та кількісним складом, але й типом зв’язків у молекулі, їхньою енергією, а також просторовим розташуванням хімічних зв’язків між атомами.
Для якісного аналізу молекулярної структури використовують модель локалізованих електронних пар. Суть її в тому, що всі електрони, які складають електронну оболонку центрального атома, поділяються на пари електронів із протилежними спінами. Одні пари утворюють хімічні зв’язки з периферичними атомами, інші — неподілені або незв’язуючі пари — не приймають участі в утворенні зв’язку, як наприклад у молекулі амоніаку NH3:
|
|
H
Усі вони розташовані у просторі так, щоб відштовхування було мінімальним. Ці електронні пари, які зумовлюють просторове або стеричне розташування атомів, називаються стеричними.
Більш точний опис структури молекули дає модель гібридних зв’язуючих орбіталей. Згідно до нею при утворенні молекули замість вихідних s-,p- та d- електронних хмар утворюються змішані хмари, які витягнуті в напрямку до сусідніх атомів. Ці хмари називають гібридними. Деформація електронних хмар потребує витрати енергії, але внаслідок більш повного перекриття електронних хмар утворюється міцніший хімічний зв’язок. Це призводить до виграшу енергії.
Залежно від форми вихідних орбіталей розрізняють такі типи гібридизації: sp-, sp2-, sp3- та ін. Кожному типу гібридизації відповідає своя геометрична форма, свої кути між зв’язками (рис.9). Так, при sp- гібридизації форма молекули лінійна, валентний кут становить 180º (BeCl2, BeF2).
При sp2- гібридизації форма молекули — плоский трикутник, кути дорівнюють 120º (BF3, BCl3, BH3).
При sp3- гібридизації форма молекули тетраедрична, валентні кути становлять 108º29’ (CH4).
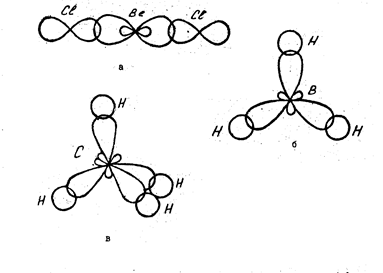 |
Рис.9. Будова молекул BeCl2(a), BH3(б), СН4(в).
Полярність молекули залежить від її просторової будови, а також від полярності окремих зв’язків. Наприклад, у молекулі вуглекислого газу СО2 зв’язки Карбону з Оксигеном полярні, однак sp-гібридизація атома Карбону призводить до лінійного розташування всіх атомів у молекулі, внаслідок чого центри позитивного та негативного зарядів збігаються. Тому молекула СО2 неполярна:
О-δ = С2δ+ = Оδ-
Кількісною мірою полярності молекул є електричний момент диполя (дипольний момент) Р. Це добуток довжини диполя lq та величини електричного заряду 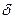 , тобто
, тобто
P = lq·δ
Як правило, чим більше дипольний момент молекули P, тим вища реакційна здатність речовини.
З електричним моментом диполя зв’язана розчинність речовин. Полярні молекули рідини сприяють електролітичній дисоціації розчинених в ній електролітів.
Таким чином, молекула — це стійке електронейтральне утворення. Однак хімічна стійкість окремих молекул відносна і виявляється лише в системах, де відстані між молекулами значно більші за їхні особисті розміри.
Вандерваальсові взаємодії .Між нейтральними молекулами на відстані одного або кількох нанометрів можуть виникати слабкі взаємодії. Вперше такі міжмолекулярні взаємодії були виявлені голандським вченим Ван-дер-Ваальсом, на честь якого і були названі. При вандерваальсовій взаємодії електронні хмари сусідніх молекул не перекриваються і хімічні зв’язки не утворюються. Цим силам приписують електростатичну природу. Залежно від природи системи виділяють три складові вандерваальсових сил: орієнтаційну, індукційну та дисперсійну.
Для полярних молекул (Н2О, НСl, NH3) основою міжмолекулярної взаємодії є наявність у молекул постійного дипольного моменту Р. Електростатичне притягання, що виникає між відповідним чином орієнтованими диполями, називається орієнтаційною (або дипольною) складовою сил Ван-дер- Ваальса.
У системах, що містять полярні та неполярні молекули, може виникнути взаємодія між молекулами, зумовлена електростатичним притяганням диполів полярних молекул та наведених (індукційних) диполів неполярних молекул. Останні виникають внаслідок поляризації під впливом електричних полів диполів полярних молекул. Такий ефект називають індукційною складовою сил Ван-дер-Ваальса.
Найбільш універсальною взаємодією є дисперсійна міжмолекулярна взаємодія. Вона зумовлена існуванням у молекул миттєвих мікродиполів. При зближенні молекул орієнтація мікродиполів перестає бути незалежною і їхні поява та зникнення в різних молекулах відбуваються в такт один одному (рис.10).
При узгодженому русі електронів такі миттєві диполі орієнтуються один до одного протилежно зарядженими кінцями, внаслідок чого відбувається їхнє електростатичне притягання, що супроводжується виграшем енергії.
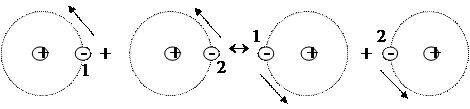 |
Рис. 10. Орієнтація миттєвих мікро диполів.
Дисперсійні сили (або сили Лондона, 1927р.) зростають зі збільшенням радіусів атомів (молекул), оскільки електронна оболонка стає більш пухкою і легше поляризується. Наприклад, у VII групі серед галогенів фтор F2, хлор Cl2 — гази з температурами кипіння -187°С та -34°С відповідно, бром Br2 — рідина з температурою кипіння 58°С, а йод I2 — тверда речовина з температурою кипіння 180°С. Серед органічних сполук найсильніша дисперсійна взаємодія між молекулами з довгими нерозгалуженими ланцюгами, між якими може виникнути багато точок зіткнення.
Вандерваальсовим взаємодіям притаманна невелика енергія, сумірна до енергії теплового руху частинок і приблизно на порядок менша за енергію хімічного зв’язку.
Вандерваальсові сили відрізняються від ковалентних сил ненапрямленістю та ненасиченістю, а також тим, що вони проявляються на значно більших від-станях.
Водневий зв’язок. Водневий зв’язок має проміжний характер між вандерваальсовими взаємодіями та ковалентним зв’язком. Він виникає між позитивно поляризованим атомом Гідрогену однієї молекули та негативно поляризованим атомом з великою електронегативністю (наприклад, атомами Флуору, Оксигену, Нітрогену або Сульфуру) іншої молекули. На відміну від звичайної диполь-дипольної взаємодії, механізм виникнення водневого зв’язку в значній мірі зумовлений і донорно-акцепторною взаємодією, де донором є атом електронегативного елемента однієї молекули, а акцептором — атом Гідрогену іншої. Таким чином виникає взаємодія, яка має електростатичний і частково донорно- акцепторний характер. Тому властивостями водневого зв’язку є напрямленість та насиченість.
Водневий зв’язок умовно записують як Х - Н…У, де Х і У — сильно електронегативні атоми, а водневий зв’язок позначається крапками. Наприклад, у молекулі фтороводню H+dF-d атом Флуору взаємодіє не тільки з атомом Гідрогену своєї молекули, а й з атомом Гідрогену іншої молекули:
Енергія водневого зв’язку складає 8-40 кДж/моль і займає проміжне положення між енергіями ковалентного зв’язку і звичайного міжмолекулярного зв’язку (сили Ван-дер-Ваальса)
 F…H
F…H
H+d - F-d + H+d - F-d ® Н F .
Водневий зв’язок відіграє важливу роль у процесах кристалізації та розчинення речовин, в утворенні кристалогідратів, асоціатів та ін. Так високі температури плавлення та кипіння Н2О, HF, NH3 зумовлюються утворенням асоціатів через водневі зв’язки.
