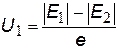Атом водорода и водородоподобные атомы (ВПА) по теории Бора
На рис. показан водородоподобный атом. Заряд ядра равен +Ze, где Z число протонов (и номер элемента в таблице Менделеева). Вокруг ядра вращается по круговой орбите электрон е со скоростью v. На электрон действует со стороны ядра кулоновская сила Fкул. Запишем II закон Ньютона для электрона: man=Fкул., где an = v2/ r - нормальное ускорение. (Взаимодействие электрона с другими электронами атома не учитываем).
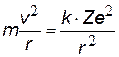 z z | II закон Ньютона и закон Кулона, к=1/4peо – коэффициент в СИ | 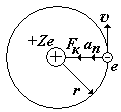 | Для атома водорода Z = 1 |
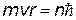 y y | постулат Бора |
Из этих формул получим выражения для скорости v и радиуса r орбиты электрона. Сократим в уравнении (z) на r, а оставшующуюся r перенесем в числитель левой части уравнения. Затем разделим уравнение (z) на (y) и получим v. Подставим v в (y) и найдем r.
Внимание! Легче запомнить вывод формул для v и r, чем сами формулы для них.
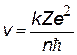 | скорость электрона на орбите, квантуется как v ~ 1/n; v1 = 2,2×106 м/с |
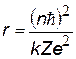 | радиус орбиты электрона, квантуется как r ~ n2 r1 = 0,53 нм – первый боровский радиус |
Когда электрон в атоме Н находится на 1-ой орбите, говорят, что электрон (или атом) находится в основном (невозбужденном) состоянии, при этом электрон имеет минимальную энергию. Все остальные состояния называются возбужденными состояниями.
Полная энергия Е электрона складывается из кинетической W и потенциальной U энергий: Е = W + U. Выразим их в идентичной форме:
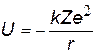 | Потенциальная энергия взаимодействия электрона с ядром отрицательна, т.к. нулевой уровень принят на бесконечности (U¥ = 0), чем ближе к ядру, тем меньше энергия электрона. | |
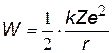 | Кинетическая энергия, получается из (z), т.к. W=mv2/2 | |
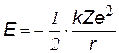 | Полная энергия: Е = W + U Подставив выражение для r, получим формулу: | |
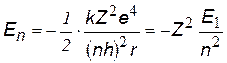 x x | Полная энергия электрона на n-ой орбите, квантуется как Е ~ 1/n2; вычисления дают: | |
| Е1 @ - 13,6 эВ Е1ВПА @ - Z 2 ×13,6 эВ | Энергия электрона на 1-ой орбите в атоме водорода и водородоподобных атомах (ВПА). | |
Из формулы (x) можно получить также:
|
Внимание!Не забывайте, что электронвольты и вольты численно равны.
Если подставить во 2-й постулат Бора 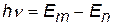 выражение (x), получим:
выражение (x), получим:
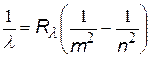 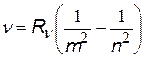 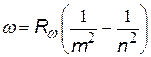 | все три формулы имеют одно и то же название – сериальные формулы, а константы называются постоянными Ридберга, хотя и имеют различные числовые значения |
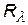 = 1,097×107 1/м = 1,097×107 1/м 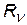 = 3,29×1015 1/с = 3,29×1015 1/с 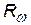 = 2,067×1016 1/с = 2,067×1016 1/с | 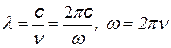 с помощью этих формул можно выразить одну постоянную через другую с помощью этих формул можно выразить одну постоянную через другую |
Сериальная формула была известна из опыта до появления теории Бора.
Закономерности в видимом спектре атома Н были обнаружены Бальмером еще в 1885 г. Затем были открыты другие серии. Они получили следующие названия:
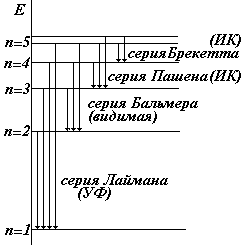 | серия Лаймана | 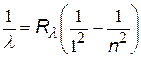 | n = 2, 3, 4,… |
| серия Бальмера | 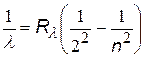 | n = 3, 4, 5,… | |
| серия Пашена | 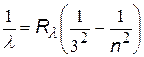 | n = 4, 5, 6,… | |
| серия Брекетта | 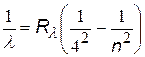 | n = 5, 6, 7,… |
Головными линиями серий называют: серия Лаймана переход 2®1, серия Бальмера переход 3®2, серия Пашена переход 4®3.
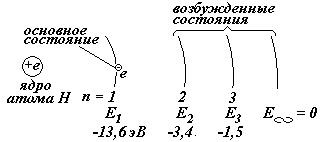 Чтобы электрон перешел на более удаленную орбиту, необходимо внешнее воздействие. Например, можно газ нагревать, или освещать светом, или к электродам в баллоне с газом приложить разность потенциалов. Среднее время жизни электрона на этой орбите порядка 10-8 секунды.
Чтобы электрон перешел на более удаленную орбиту, необходимо внешнее воздействие. Например, можно газ нагревать, или освещать светом, или к электродам в баллоне с газом приложить разность потенциалов. Среднее время жизни электрона на этой орбите порядка 10-8 секунды.
ПРИНЦИПЫ КВАНТОВОЙ МЕХАНИКИ. УРАВНЕНИЕ ШРЁДИНГЕРА.