Атмосфера гидротермодинамикасының теңдеулері, Күй теңдеуі
Атмосфера термодинамикасы-қозғалуы ауаның ішкі күйінің ішкі параметрлерінің өзгеруін және бұл өзгерумен байланысқан жылулық энергиядан механикалыққа өту процесін зерттейтін динамикалық метеорологияның бір саласы болып табылады.
Атмосфера термодинамикасында физика курсынан оқытатын жалпы термодинамиканың 1 және 2 бастамаларынан шығатын қорытындылар кеңінен қолданылады.
Энергияның сақталу заңының жылу құбылысына қолданылуын термодинамиканың 1 ші бастамасы деп аталады. Яғни берілген жылу мөлшері ішкі энергияның өзгерісіне және атқаратын жұмысына кетеді.
Q=U+A
Q-газға берілген жылу мөлшері
U- бір атомды идеал газдың ішкі энергиясының өзгерісі
A- көлемнің шекті өзгерісі кезінде атқаратын жұмыс шамасы.
Термодинамиканың 2 бастамасы дегеніміз жылу процесінің қайтымсыздығы және бағытын сипаттайтын заң барлық термодинамикалық жылу процесстер жоғары температурадағы жүйеден температурасы төменге бағытталған. Атмосфералық ауаның құрамы әртүрлі компоненттен тұрады. Олардың ішінде ең көп өзгеретіні су буының мөлшері және әртүрлі өлшенген қоспалар.
Ауаның негізгі құраушысы азот, оттегі аргон және көмірқышқыл газы болып табылады. Ауаның құрамына кіретін газдардың қасиеттерін идеал газдың қоспасы ретінде қарастыруға болады.
Жалпы идеал газ дегеніміз газ молекулаарының материалдық нүкте ретінде қарастыруға болатын және олардың бір бірімен әсерлесуі жоқ тек серпімді соқтығысуымен әсерлесетін газ.
Атмос-қ физикалық күйіне термодинамика жүйелер ретінде сипаттайтын негізгі параметрлер болып оның тығыздығы, қысымы және абсолютті температурасы табылады.
Абсолютті температура: Т= 273,15+t
Температура абс. 0 кезінде идеал газдың молекулалы қозғалысын тоқтатады.
Бұл 3 параметрлер бір-бірімен келесі қатынас арқ. байланысқан:
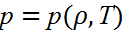 – күй теңдеуі д.а.
– күй теңдеуі д.а.
Бұл теңдеудің анық түрі Бойль- Марриот ж/е Шарль заң/ынан анықтап алуға болады.
Бойль Мапрриот заңы қысым мен көлемді байланыстырады. Яғни Т=const және газдың тұрақты массасында қысымның көлемге көбейтіндісі тұрақты болып қалады.PV=const
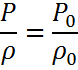
Шарль заңы газдың берілген массасында және тұрақты көлем кезінде қысымның температураға қатынасы тұрақты болады.
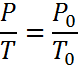
Бұл заңдар молекулалардың озара әрекеттесу күші және өзіндік көлемі өте аз нақты газдар үшін ғана орындалады.
Қалыпты жағдайда Р=1013,25гПа, Т=273,15 К болғанда кез келген газдың 1 грамм молекуласының көлемі V=22414 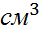 тең.
тең.
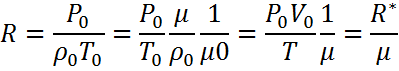
М- газдың молекулалық салмағы
R-универсалды газ тұрақтысы
Халықаралық СИ жүйесінде кез келген газдың универсалы Газ тұрақтысы.
R= 8,31*10 Дж/Кмоль*К
Әртүрлі газдар үшін өзіндік газ тұрақтысы әртүрлі және ол сол газдың молекулалық салмағына тәуелді болып келеді.
Құрғақ ауаның е/лы молекулалық салмағы М=28,97-ге тең. Сондықтан құрғақ ауаның өзіндік газ тұрақтысы
Rқ=8,31*10/2*97=287 Дж/кг К.
P= 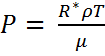
Куй теңдеуін былай жазуға болады: 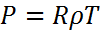
Ылғалды ауаның вертикалды температурасы оның нақты температурасынан әрқашан да үлкен. Сондықтан күй теңдеуінен бірдей қысыммен температурасы жағдайында ылғалды ауаның құрғақ ауадан жеңіл екенін көруге болады.
